A todos nos enseñaron desde niños que hay sentidos 5: vista, gusto, sonido, olfato y tacto. Los cuatro sentidos iniciales utilizan órganos claros y distintos, como los ojos, las papilas gustativas, las orejas y la nariz, pero ¿cómo siente el cuerpo exactamente el tacto? El tacto se experimenta en todo el cuerpo, tanto dentro como fuera. No hay un órgano distinto que sea responsable de sentir el tacto. Por el contrario, existen diminutos receptores o terminaciones nerviosas alrededor de todo el cuerpo que detectan el tacto donde se produce y envía señales al cerebro con información sobre el tipo de contacto que se produjo. Como una papila gustativa en la lengua detecta el sabor, los mecanorreceptores son glándulas de la piel y de otros órganos que detectan sensaciones de contacto. Ellos son conocidos como mecanorreceptores porque están diseñados para detectar sensaciones mecánicas o diferencias en la presión.
Papel de los mecanorreceptores
Una persona entiende que ha experimentado una sensación una vez que el órgano responsable de descubrir ese sentido específico envía un mensaje al cerebro, que es el órgano primario que procesa y organiza toda la información. Los mensajes se envían desde todas las áreas del cuerpo al cerebro a través de cables conocidos como neuronas. Hay miles de pequeñas neuronas que se ramifican a todas las áreas del cuerpo humano, y en las terminaciones de muchas de estas neuronas son mecanorreceptores. Para demostrar lo que sucede cuando tocas un objeto, usaremos un ejemplo.
Imagine que un mosquito aterriza en su brazo. La tensión de este insecto, tan ligero, estimula los mecanorreceptores en esa área particular del brazo. Esos mecanorreceptores envían un mensaje a lo largo de la neurona a la que están conectados. La neurona conecta todo el camino hasta el cerebro, que recibe el mensaje de que algo está tocando su cuerpo en la ubicación exacta del mecanorreceptor específico que envió el mensaje. El cerebro actuará con este consejo. Tal vez le dirá a los ojos que miren la región del brazo que detectó la firma. Y cuando los ojos le dicen al cerebro que hay un mosquito en el brazo, el cerebro puede decirle a la mano que lo quite rápidamente. Así es como funcionan los mecanorreceptores. El objetivo del siguiente artículo es demostrar y discutir en detalle la organización funcional y los determinantes moleculares de los mecanorreceptores.
Touch Sense: Organización Funcional y Determinantes Moleculares de Receptores Mecanismo-Sensitivos
Resumen
Los mecanorreceptores cutáneos se localizan en las diversas capas de la piel, donde detectan una amplia gama de estímulos mecánicos, que incluyen cepillado ligero, estiramiento, vibración y presión nociva. Esta variedad de estímulos se combina con una gran variedad de mecanorreceptores especializados que responden a la deformación cutánea de una manera específica y retransmiten estos estímulos a estructuras cerebrales superiores. Los estudios a través de mecanoreceptores y terminaciones nerviosas sensoriales tratables genéticamente están comenzando a descubrir mecanismos de sensación táctil. El trabajo en este campo ha proporcionado a los investigadores una comprensión más completa de la organización del circuito subyacente a la percepción del tacto. Los nuevos canales de iones han surgido como candidatos para las moléculas de transducción y las propiedades de las corrientes mecánicamente controladas mejoraron nuestra comprensión de los mecanismos de adaptación a los estímulos táctiles. Esta revisión destaca el progreso realizado en la caracterización de las propiedades funcionales de los mecanorreceptores en la piel peluda y glabra y los canales iónicos que detectan los insumos mecánicos y dan forma a la adaptación de los mecanoreceptores.
Palabras clave: mecanorreceptor, canal mecanosensible, dolor, piel, sistema somatosensorial, tacto
Introducción
El tacto es la detección de estímulos mecánicos que afectan a la piel, incluidos estímulos mecánicos inocuos y nocivos. Es un sentido esencial para la supervivencia y el desarrollo de mamíferos y humanos. El contacto de objetos sólidos y fluidos con la piel proporciona la información necesaria para el sistema nervioso central que permite la exploración y el reconocimiento del entorno e inicia la locomoción o el movimiento planificado de la mano. El tacto también es muy importante para el aprendizaje, los contactos sociales y la sexualidad. El sentido del tacto es el sentido menos vulnerable, aunque puede distorsionarse (hiperestesia, hipoestesia) en muchas condiciones patológicas. 1-3
Las respuestas táctiles implican una codificación muy precisa de información mecánica. Los mecanorreceptores cutáneos se localizan en las diversas capas de la piel donde detectan una amplia gama de estímulos mecánicos, incluido el roce ligero, el estiramiento, la vibración, la desviación del cabello y la presión nociva. Esta variedad de estímulos se corresponde con una diversa gama de mecanorreceptores especializados que responden a la deformación cutánea de una manera específica y transmiten estos estímulos a las estructuras cerebrales superiores. Las neuronas somatosensoriales de la piel se dividen en dos grupos: mecanorreceptores de bajo umbral (LTMR) que reaccionan a la presión benigna y mecanorreceptores de alto umbral (HTMR) que responden a la estimulación mecánica dañina. Los cuerpos celulares de LTMR y HTMR residen dentro de los ganglios de la raíz dorsal (DRG) y los ganglios sensoriales craneales (ganglios del trigémino). Las fibras nerviosas asociadas con LTMR y HTMR se clasifican como fibras Aβ-, Aδ- o C en función de sus velocidades de conducción del potencial de acción. Las fibras C no están mielinizadas y tienen las velocidades de conducción más lentas (~2 m/s), mientras que las fibras Aδ y Aβ están leve y fuertemente mielinizadas y exhiben velocidades de conducción intermedias (~12 m/s) y rápidas (~20 m/s). , respectivamente. Los LTMR también se clasifican como respuestas de adaptación lenta o rápida (SA- y RA-LTMR) según sus tasas de adaptación al estímulo mecánico sostenido. Se distinguen además por los órganos terminales cutáneos que inervan y sus estímulos preferidos.
La capacidad de los mecanorreceptores para detectar señales mecánicas se basa en la presencia de canales iónicos mecanotransductores que transforman rápidamente las fuerzas mecánicas en señales eléctricas y despolarizan el campo receptivo. Esta despolarización local, llamada potencial receptor, puede generar potenciales de acción que se propagan hacia el sistema nervioso central. Sin embargo, las propiedades de las moléculas que median la mecanotransducción y la adaptación a las fuerzas mecánicas siguen sin estar claras.
En esta revisión, brindamos una descripción general de las propiedades de los mecanorreceptores de mamíferos en el tacto inocuo y nocivo en la piel vellosa y glabra. También consideramos el conocimiento reciente sobre las propiedades de las corrientes activadas mecánicamente en un intento de explicar el mecanismo de adaptación de los mecanorreceptores. Finalmente, revisamos el progreso reciente realizado en la identificación de canales iónicos y proteínas asociadas responsables de la generación de corrientes activadas por mecanismos.
Toque Inocuo
LTMR asociados al folículo piloso
Los folículos capilares representan mini-órganos productores de tallo capilar que detectan el tacto ligero. Las fibras asociadas con los folículos capilares responden al movimiento del cabello y su dirección al disparar trenes de potenciales de acción al inicio y la eliminación del estímulo. Se están adaptando rápidamente a los receptores.
Gato y conejo En el pelaje de gato y conejo, los folículos pilosos se pueden dividir en tres tipos de folículos pilosos, el pelo Down, el pelo Guard y los Tylotrichs. Los plumones (pelo, lana, vello)4 son los pelos más numerosos, más cortos y finos del manto. Son ondulados, incoloros y emergen en grupos de dos a cuatro pelos de un orificio común en la piel. Los pelos Guard (monotrics, overhears, tophair)4 son ligeramente curvados, pigmentados o sin pigmentar, y emergen individualmente de la boca de sus folículos. Los tylotrichs son los menos numerosos, los pelos más largos y gruesos.5,6 Son pigmentados o no pigmentados, a veces ambos y emergen individualmente de un folículo que está rodeado por un bucle de vasos sanguíneos capilares. El suministro de fibras sensoriales a un folículo piloso se encuentra debajo de la glándula sebácea y se atribuye a las fibras Aβ o Aδ-LTMR.7
En estrecha aposición al tallo del pelo hacia abajo, justo debajo del nivel de la glándula sebácea está el anillo de terminaciones pilo-Ruffini lanceoladas. Estas terminaciones nerviosas sensoriales se colocan en un curso espiral alrededor del tallo del cabello dentro del tejido conectivo que forma el folículo piloso. Dentro del folículo piloso, también hay terminaciones nerviosas libres, algunas de ellas formando mecanorreceptores. Con frecuencia, los corpúsculos táctiles (vea piel glabra) rodean la región del cuello del folículo de tylotrich.
Las propiedades de las terminaciones nerviosas mielinizadas en la piel peluda de gatos y conejos se han explorado intensamente en el período 1930-1970 (revisión en Hamann, 1995).8 Notablemente, Brown e Iggo, estudiaron 772 unidades con fibras nerviosas aferentes mielinizadas en los nervios safenos de gato y conejo, han clasificado las respuestas en tres tipos de receptores correspondientes a los movimientos de pelo Down (receptores tipo D), pelo Guard (receptores tipo G) y pelo Tylotrich (receptor tipo T).9 Todas las respuestas de las fibras nerviosas aferentes se han llevado juntos en el receptor de Adaptación Rápida de tipo I (RA I) por oposición al receptor Pacini llamado RA II. Los mecanorreceptores RA I detectan la velocidad del estímulo mecánico y tienen un borde nítido. No detectan variaciones térmicas. Burgess et al. también describieron un receptor de campo de rápida adaptación que responde de manera óptima a las caricias de la piel o al movimiento de varios pelos, lo que se atribuyó a la estimulación de las terminaciones pilo-Ruffini. Ninguna de las respuestas del folículo piloso se atribuyó a la actividad de la fibra C.10
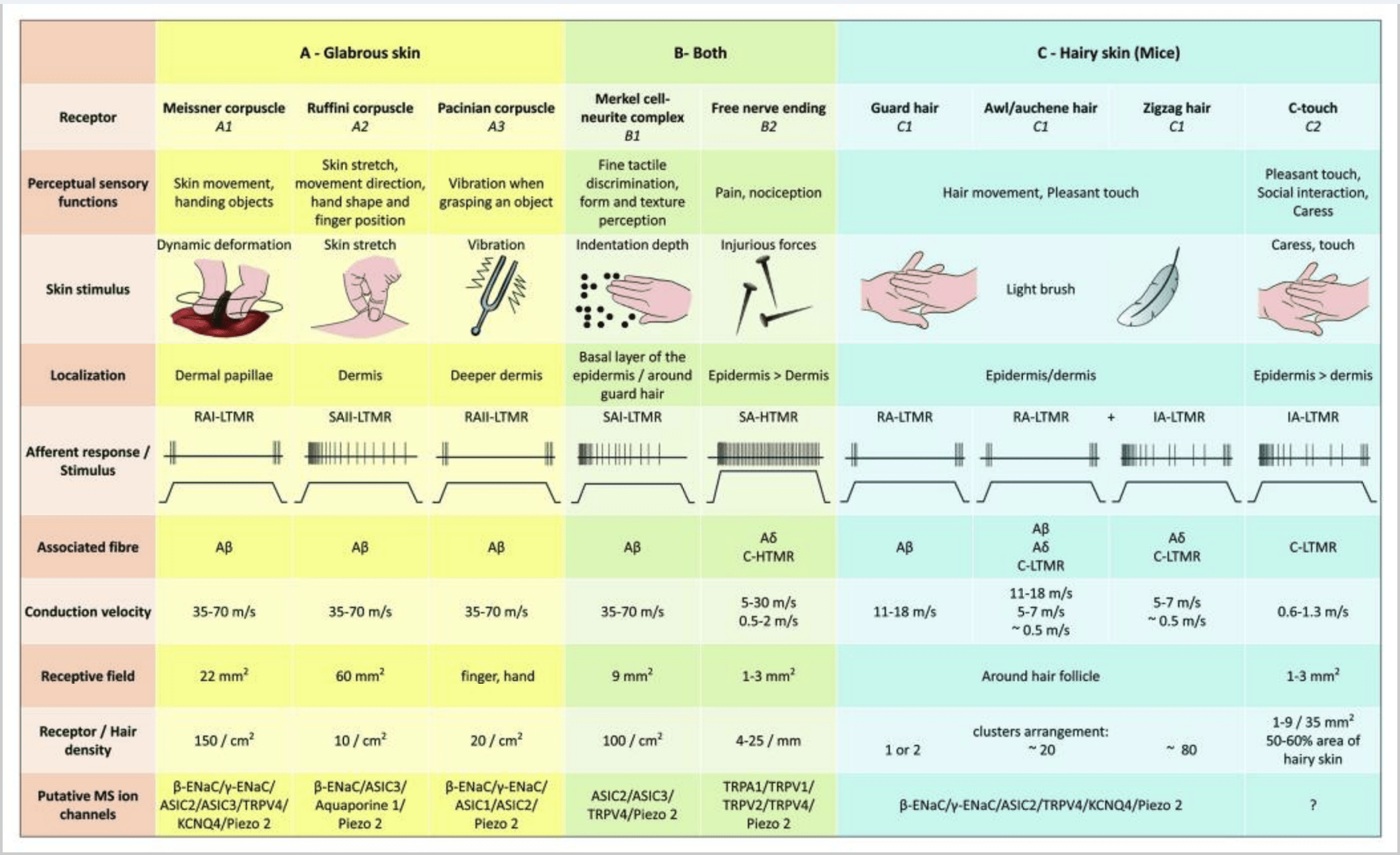
Ratones. En la piel peluda dorsal de los ratones, se han descrito tres tipos principales de folículos pilosos: zigzag (alrededor de 72%), awl / auchene (alrededor de 23%) y guard o tylotrich (alrededor de 5%). 11-14 Zigzag y Awl / los folículos del vello de auchenne producen los tallos del pelo más delgados y más cortos y están asociados con una glándula sebácea. Los pelos Guard o tylotrich son los más largos de los tipos de folículos capilares. Se caracterizan por un bulbo capilar grande asociado con dos glándulas sebáceas. Los pelos de Guard y awl / auchene están dispuestos en un patrón iterativo y regularmente espaciado, mientras que los pelos en zigzag cubren densamente las áreas de piel que rodean a los dos tipos de folículos capilares más grandes [Fig. 1 (A1, A2 y A3)].
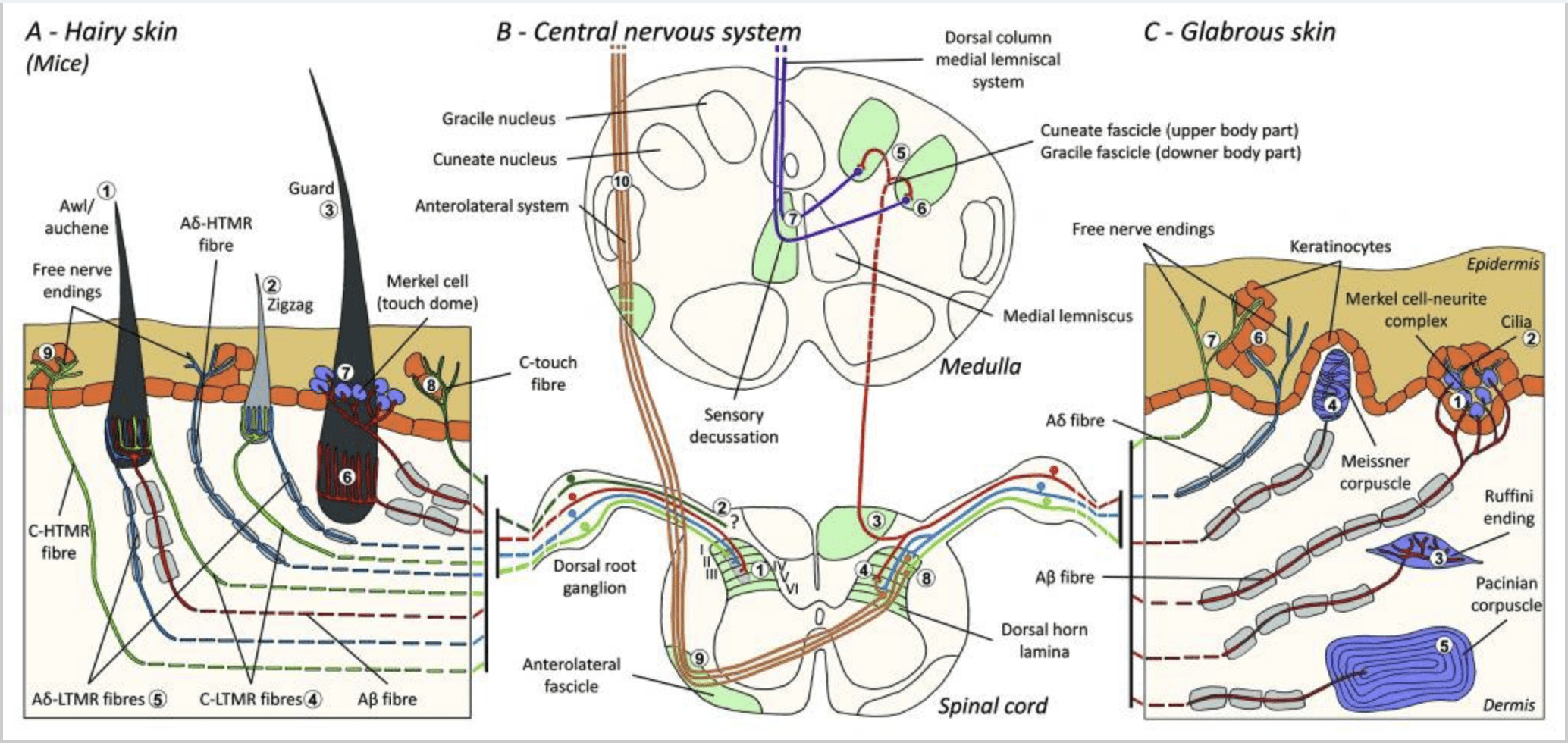
Recientemente, Ginty y sus colaboradores utilizaron una combinación de etiquetado genético molecular y enfoques de rastreo retrógrado somatotópico para visualizar la organización de las terminaciones axonales periféricas y centrales de los LTMR en ratones.15 Sus hallazgos respaldan un modelo en el que las características individuales de un estímulo táctil complejo son extraído por los tres tipos de folículos pilosos y transmitido a través de las actividades de combinaciones únicas de fibras Aβ-, Aδ- y C- al asta dorsal.
Demostraron que el etiquetado genético de las neuronas DRG tirosina hidroxilasa positivas (TH+) caracteriza una población de neuronas sensoriales de pequeño diámetro no peptidérgicas y permite la visualización de terminaciones periféricas C-LTMR en la piel. Sorprendentemente, se encontró que las ramas axoneales de los C-LTMR individuales arborizan y forman terminaciones lanceoladas longitudinales que están íntimamente asociadas con zigzag (80 % de las terminaciones) y punzón/auchena (20 % de las terminaciones), pero no con folículos pilosos tilotricos [Fig. 1 (A4)]. Durante mucho tiempo se pensó que las terminaciones lanceoladas longitudinales pertenecían exclusivamente a los Aβ-LTMR y, por lo tanto, era inesperado que las terminaciones de los C-LTMR formaran terminaciones lanceoladas longitudinales.15 Estos C-LTMR tienen una adaptación intermedia en comparación con los mielinizados de adaptación lenta y rápida. mecanorreceptores [Fig. 2 (C1)].
Una segunda población importante identificada se refiere a las terminaciones Aδ-LTMR en Awl/Auchenne y folículos en zigzag que se compararán con el folículo de pelo de Down ampliamente estudiado en gatos y conejos. Ginty y colaboradores demostraron que TrkB se expresa en niveles altos en un subconjunto de neuronas DRG de diámetro medio. Los registros intracelulares utilizando la preparación de piel y nervios ex vivo de fibras marcadas revelaron que exhiben las propiedades fisiológicas de las fibras previamente estudiadas en gatos y conejos: exquisita sensibilidad mecánica (umbral de Von Frey < 0.07 mN), respuestas de rápida adaptación a estímulos por encima del umbral, conducción intermedia velocidades (5.8 ± 0.9 m/s) y puntas de soma estrechas y no flexionadas.15 Estos Aδ-LTMR forman terminaciones lanceoladas longitudinales asociadas con prácticamente todos los folículos pilosos en zigzag y punzón/auchene del tronco [Fig. 1 (A5)].
Finalmente, demostraron que las terminaciones periféricas de los LTMR Aβ que se adaptan rápidamente forman terminaciones lanceoladas longitudinales asociadas con los folículos pilosos guard (o tylotrich) y punzón/auchene [Fig. 1 (A6)].15 Además, los pelos Guard también están asociados con un complejo de células de Merkel que forma una cúpula táctil conectada a Aβ que se adapta lentamente a LTMR [Fig. 1 (A7)].
En resumen, prácticamente todos los folículos pilosos en zigzag están inervados por terminaciones lanceoladas C-LTMR y Aδ-LTMR; los pelos punzón/auchene están triplemente inervados por las terminaciones lanceoladas Aβ de rápida adaptación-LTMR, Aδ-LTMR y C-LTMR; Los folículos pilosos protectores están inervados por terminaciones lanceoladas longitudinales Aβ de adaptación rápida-LTMR e interactúan con terminaciones de cúpula táctil Aβ de adaptación lenta-LTMR. Por lo tanto, cada folículo piloso de ratón recibe combinaciones únicas e invariables de terminaciones LTMR correspondientes a órganos finales mecanosensoriales neurofisiológicamente distintos. Teniendo en cuenta la disposición iterativa de estos tres tipos de cabello, Ginty y sus colaboradores proponen que la piel pilosa consiste en una repetición iterativa de la unidad periférica que contiene (1) uno o dos cabellos protectores ubicados en el centro, (2) ~20 cabellos punzantes/auchenne circundantes y (3 ) ~80 pelos en zigzag intercalados [Fig. 2 (C1)].
Proyección de la médula espinal. Las proyecciones centrales de Aβ de adaptación rápida-LTMR, Aδ-LTMR y C-LTMR terminan en láminas distintas, pero parcialmente superpuestas (II, III, IV) del asta dorsal de la médula espinal. Además, las terminales centrales de los LTMR que inervan los mismos folículos pilosos o los adyacentes dentro de una unidad LTMR periférica se alinean para formar una columna LTMR estrecha en el asta dorsal de la médula espinal [Fig. 1 (B1)]. Por lo tanto, parece probable que una cuña o columna de terminaciones aferentes sensoriales primarias organizadas somatotópicamente en el asta dorsal represente la alineación de las proyecciones centrales de Aβ-, Aδ- y C-LTMR que inervan la misma unidad periférica y detectan estímulos mecánicos. actuando sobre el mismo pequeño grupo de folículos pilosos. Con base en el número de pelos de guarda, punzón/auchene y zigzag del tronco y las extremidades y el número de cada subtipo LTMR, Ginty y sus colaboradores estiman que el asta dorsal del ratón contiene de 2,000 a 4,000 columnas LTMR, lo que corresponde al número aproximado de unidades LTMR periféricas.15
Además, los axones de los subtipos LTMR están estrechamente asociados entre sí, con proyecciones entrelazadas y terminaciones lanceoladas interdigitadas que inervan el mismo folículo piloso. Además, debido a que los tres tipos de folículos pilosos exhiben diferentes formas, tamaños y composiciones celulares, es probable que tengan distintas propiedades de ajuste vibracional o de desviación. Estos hallazgos son consistentes con las mediciones neurofisiológicas clásicas en gatos y conejos que indican que los Aβ RA-LTMR y los Aδ-LTMR pueden activarse de manera diferencial mediante la desviación de distintos tipos de folículos pilosos.16,17
En conclusión, el tacto en la piel vellosa es la combinación de: (1) los números relativos, las distribuciones espaciales únicas y las distintas propiedades morfológicas y de desviación de los tres tipos de folículos capilares; (2) las combinaciones únicas de terminaciones de subtipo LTMR asociadas con cada uno de los tres tipos de folículos pilosos; y (3) distintas sensibilidades, velocidades de conducción, patrones de espinas y propiedades de adaptación de las cuatro clases principales de LTMR asociados al folículo piloso que permiten que el sistema mecanosensorial de la piel peluda extraiga y transmita al SNC las complejas combinaciones de cualidades que definen un toque.
Free-Nerve Endings LTMRs
Generalmente, las terminaciones libres de fibras C en la piel son HTMR, pero una subpoblación de fibras C no responde al contacto nocivo. Este subconjunto de aferentes táctiles de fibra C (CT) representa un tipo distinto de unidades mecanorreceptoras amielínicas de bajo umbral que existen en la piel peluda pero no glabra de humanos y mamíferos [Fig. 1 (A8)].18,19 Las TC generalmente se asocian con la percepción de una estimulación táctil agradable en el contacto corporal.20,21
Los aferentes de CT responden a fuerzas de indentación en el rango de 0.3 a 2.5 mN y, por lo tanto, son tan sensibles a la deformación de la piel como muchos de los aferentes Aβ.19 Las características de adaptación de los aferentes de CT son, por lo tanto, intermedias en comparación con los mecanorreceptores mielinizados de adaptación lenta y rápida. . Los campos receptivos de los aferentes de CT humanos tienen una forma aproximadamente redonda u ovalada. El campo consta de uno a nueve pequeños puntos sensibles distribuidos en un área de hasta 35 mm2.22 Los receptores homólogos de ratón están organizados en un patrón de parches discontinuos que cubren aproximadamente el 50-60% del área de la piel pilosa [Fig. 2 (C2)].23
La evidencia de pacientes que carecen de aferentes mielinizados táctil indica que la señalización en las fibras de CT activa la corteza insular. Como este sistema es pobre en la codificación de aspectos discriminatorios del tacto, pero adecuado para codificar un tacto lento y suave, las fibras de TC en la piel vellosa pueden ser parte de un sistema para procesar aspectos agradables y socialmente relevantes del tacto. La activación de la fibra 24 CT también puede tienen un papel en la inhibición del dolor y recientemente se ha propuesto que la inflamación o el trauma pueden cambiar la sensación transmitida por los LTMR de fibra C del tacto agradable al dolor.25,26
A qué camino viajan los aferentes CT aún no se conoce [Fig. 1 (B2)], pero las entradas táctiles de bajo umbral a las células de proyección espinotalámica han sido documentadas, y 27 otorga credibilidad a los informes de déficits contralaterales sutiles de detección táctil en pacientes humanos después de la destrucción de estas vías después de procedimientos de acordeotomía.28
LTMR en piel glabra
Complejo de neuronas celulares Merkel y domo táctil. Merkel (1875) fue el primero en dar una descripción histológica de grupos de células epidérmicas con grandes núcleos lobulados, en contacto con presuntas fibras nerviosas aferentes. Supuso que favorecían el sentido del tacto llamándolos Tastzellen (células táctiles). En los seres humanos, los complejos de células de Merkel-neurita están enriquecidos en las áreas sensibles al tacto de la piel, se encuentran en la capa basal de la epidermis en los dedos, los labios y los genitales. También existen en pieles peludas a menor densidad. El complejo de células de Merkel-neurita consta de una célula de Merkel en estrecha aposición a una terminal nerviosa agrandada de una única fibra mielínica Aβ [Fig. 1 (C1)] (revisión en Halata y colaboradores).29 En el lado epidérmico, la célula de Merkel exhibe procesos similares a dedos que se extienden entre los queratinocitos vecinos [Fig. 1 (C2)]. Las células de Merkel son células epidérmicas derivadas de queratinocitos.30,31 El término domo táctil se introdujo para denominar la gran concentración de complejos de células de Merkel en la piel peluda de la pata delantera del gato. Una cúpula táctil podría tener hasta 150 células de Merkel inervadas por una sola fibra Aβ y en humanos, además de las fibras Aβ, las fibras Aδ y C también estaban presentes regularmente.32-34
La estimulación de los complejos de células de Merkel-neurita da como resultado respuestas de tipo I (SA I) de adaptación lenta, que se originan a partir de campos receptivos puntuados con bordes definidos. No hay descarga espontánea. Estos complejos responden a la profundidad de indentación de la piel y tienen la resolución espacial más alta (0.5 mm) de los mecanorreceptores cutáneos. Transmiten una imagen espacial precisa de los estímulos táctiles y se propone que sean responsables de la discriminación de formas y texturas [Fig. 2 (B1)]. Los ratones desprovistos de células de Merkel no pueden detectar superficies texturizadas con las patas mientras que lo hacen con los bigotes.35
Si la célula de Merkel, la neurona sensorial o ambas son sitios de mecanotransducción, todavía es un tema de debate. En ratas, la destrucción fototóxica de las células de Merkel suprime la respuesta SA I.36 En ratones con células de Merkel suprimidas genéticamente, la respuesta SA I registrada en la preparación ex vivo de piel/nervios desapareció por completo, lo que demuestra que las células de Merkel son necesarias para la codificación adecuada de Merkel. respuestas de los receptores.37 Sin embargo, la estimulación mecánica de células de Merkel aisladas en cultivo mediante presión impulsada por un motor no genera corrientes controladas mecánicamente.38,39 Los queratinocitos pueden desempeñar un papel importante en el funcionamiento normal del complejo de células de Merkel-neuritas. Los procesos similares a dedos de las células de Merkel pueden moverse con la deformación de la piel y el movimiento de las células de la epidermis, y este puede ser el primer paso de la transducción mecánica. Claramente, aún no se han establecido las condiciones requeridas para estudiar la mecanosensibilidad de las células de Merkel.
Terminaciones de Ruffini Las terminaciones de Ruffini son finas terminaciones sensoriales encapsuladas en forma de cigarro conectadas a las terminaciones nerviosas Aβ. Las terminaciones de Ruffini son pequeños cilindros de tejido conjuntivo dispuestos a lo largo de hebras de colágeno dérmico que reciben suministro de una a tres fibras nerviosas mielinizadas de 4 a 6 µm de diámetro. Hasta tres cilindros de diferente orientación en la dermis pueden fusionarse para formar un receptor [Fig. 1 (C3)]. Estructuralmente, las terminaciones de Ruffini son similares a los órganos tendinosos de Golgi. Se expresan ampliamente en la dermis y se han identificado como los mecanorreceptores cutáneos tipo II (SA II) de adaptación lenta. En el contexto de la actividad nerviosa espontánea, se provoca una descarga regular de adaptación lenta mediante estimulación mecánica mantenida con poca fuerza perpendicular o, más eficazmente, mediante estiramiento dérmico. La respuesta SA II se origina en grandes campos receptivos con bordes oscuros. Los receptores de Ruffini contribuyen a la percepción de la dirección del movimiento del objeto a través del patrón de estiramiento de la piel [fig. 2 (A2)].
En ratones, las respuestas SA I y SA II pueden separarse electrofisiológicamente en la preparación de la piel nerviosa ex vivo. 40 Nandasena y sus colaboradores informaron la inmunolocalización de aquaporina 1 (AQP1) en las terminaciones periodontales Ruffini de los incisivos de rata, lo que sugiere que AQP1 está involucrado el mantenimiento del equilibrio osmótico dental necesario para la mecanotransducción.41 Las terminaciones periodontales Ruffini también expresaron el supuesto canal iónico mecanosensible ASIC3.42
Corpúsculos de Meissner. Los corpúsculos de Meissner se localizan en las papilas dérmicas de la piel lampiña, principalmente en las palmas de las manos y las plantas de los pies, pero también en los labios, la lengua, la cara, los pezones y los genitales. Anatómicamente, consisten en una terminación nerviosa encapsulada, la cápsula está hecha de células de soporte aplanadas dispuestas como laminillas horizontales incrustadas en tejido conectivo. Hay una sola fibra nerviosa Aβ aferentes conectadas por corpúsculo [Fig. 1 (C4)]. Cualquier deformación física del corpúsculo desencadena una andanada de potenciales de acción que cesa rápidamente, es decir, son receptores de rápida adaptación. Cuando se elimina el estímulo, el corpúsculo recupera su forma y, al hacerlo, produce otra andanada de potenciales de acción. Debido a su ubicación superficial en la dermis, estos corpúsculos responden selectivamente al movimiento de la piel, detección táctil de deslizamiento y vibraciones (20-40 Hz). Son sensibles a la piel dinámica, por ejemplo, entre la piel y un objeto que se está manipulando [Fig. 2 (A1)].
Corpúsculos de Pacini Los corpúsculos de Pacini son los mecanorreceptores más profundos de la piel y son los mecanorreceptores cutáneos encapsulados más sensibles del movimiento de la piel. Estos grandes corpúsculos ovoides (1 mm de longitud) hechos de láminas concéntricas de tejido conjuntivo fibroso y fibroblastos revestidos por células planas de Schwann modificadas se expresan en la dermis profunda.43 En el centro del corpúsculo, en una cavidad llena de líquido llamada bulbo interno , termina una única terminación nerviosa amielínica aferente Aβ [Fig. 1 (C5)]. Tienen un gran campo receptivo en la superficie de la piel con un centro especialmente sensible. El desarrollo y la función de varios tipos de mecanorreceptores de rápida adaptación se interrumpen en ratones mutantes c-Maf. En particular, los corpúsculos de Pacini están severamente atrofiados.44
Los corpúsculos de Pacini muestran una adaptación muy rápida en respuesta a la indentación de la piel, la descarga nerviosa de adaptación rápida II (RA II) que son capaces de seguir estímulos vibratorios de alta frecuencia y permiten la percepción de eventos distantes a través de vibraciones transmitidas.45 Corpúsculo de Pacini los aferentes responden a la indentación sostenida con actividad transitoria al inicio y final del estímulo. También se denominan detectores de aceleración porque pueden detectar cambios en la fuerza del estímulo y, si se altera la tasa de cambio del estímulo (como ocurre con las vibraciones), su respuesta se vuelve proporcional a este cambio. Los corpúsculos de Pacini detectan cambios de presión bruscos y, sobre todo, vibraciones (150-300 Hz), que pueden detectar incluso a centímetros de distancia [Fig. 2 (A3)].
La respuesta tónica se observó en el corpúsculo de Pacinian descapsulado.46 Además, los corpúsculos de Pacini intactos responden con actividad sostenida durante los estímulos de indentación constante, sin alterar los umbrales mecánicos o la frecuencia de respuesta cuando la señalización mediada por GABA está bloqueada entre la glía laminar y una terminación nerviosa.47 los componentes no neuronales del corpúsculo de Pacini pueden tener un doble papel en el filtrado del estímulo mecánico y en la modulación de las propiedades de respuesta de la neurona sensorial.
Proyecciones de la médula espinal. Las proyecciones de los Aβ-LTMR en la médula espinal se dividen en dos ramas. La rama central principal asciende en la médula espinal en las columnas dorsales ipsolaterales hasta el nivel cervical [Fig. 1 (B3)]. Las ramas secundarias terminan en el asta dorsal en la lámina IV e interfieren con la transmisión del dolor, por ejemplo. Esto puede atenuar el dolor como parte del control de puerta [Fig. 1 (B4)].48
A nivel cervical, los axones de la rama principal se separan en dos tramos: el tracto medio comprende el fascículo grácil que transporta información desde la mitad inferior del cuerpo (piernas y tronco), y el tracto externo comprende el fascículo cuneado que transmite información desde la mitad superior del cuerpo (brazos y tronco) [Fig. 1 (B5)].
Los aferentes táctiles primarios hacen su primera sinapsis con neuronas de segundo orden en el bulbo raquídeo, donde las fibras de cada tracto hacen sinapsis en un núcleo del mismo nombre: los axones del fascículo grácil hacen sinapsis en el núcleo grácil y los axones cuneiformes hacen sinapsis en el núcleo cuneiforme [fig. 1 (B6)]. Las neuronas que reciben la sinapsis proporcionan los aferentes secundarios y cruzan la línea media inmediatamente para formar un tracto en el lado contralateral del tronco encefálico, el lemnisco medial, que asciende a través del tronco encefálico hasta la siguiente estación de relevo en el mesencéfalo, específicamente, en el tálamo. [Higo. 1 (B7)].
Especificación molecular de LTMRs Los mecanismos moleculares que controlan la diversificación temprana de los LTMR se han dilucidado parcialmente recientemente. Bourane y colaboradores han demostrado que las poblaciones neuronales que expresan el receptor de tirosina quinasa Ret (Ret) y su co-receptor GFRα2 en ratones embrionarios E11-13 DRG coexpresan selectivamente el factor de transcripción Mafa.49,50 Estos autores demuestran que el Mafa /Ret/GFRα2 neuronas destinadas a convertirse en tres tipos específicos de LTRM al nacer: las neuronas SA1 que inervan los complejos de células de Merkel, las neuronas de rápida adaptación que inervan los corpúsculos de Meissner y las aferentes de rápida adaptación (RA I) que forman terminaciones lanceoladas alrededor de los folículos pilosos. Ginty y sus colaboradores también informan que las neuronas DRG que expresan Ret temprana son mecanorreceptores de rápida adaptación de los corpúsculos de Meissner, los corpúsculos de Pacini y las terminaciones lanceoladas alrededor de los folículos pilosos.51 Inervan zonas diana discretas dentro de los núcleos grácil y cuneiforme, lo que revela un patrón mecanosensorial específico de la modalidad. proyecciones axonales de neuronas dentro del tronco encefálico.
Exploración de mecanorreceptores de la piel humana. La técnica de "microneurografía" descrita por Hagbarth y Vallbo en 1968 se ha aplicado para estudiar el comportamiento de descarga de terminaciones mecanosensibles humanas únicas que inervan músculos, articulaciones y piel (ver para revisión Macefield, 2005).52,53 La mayoría de la piel humana estudios de microneurografía han caracterizado la fisiología de los aferentes táctiles en la piel glabra de la mano. Las grabaciones de microelectrodos de los nervios mediano y cubital en sujetos humanos han revelado la sensación táctil generada por las cuatro clases de LTMR: los aferentes de Meissner son particularmente sensibles a la luz que acaricia la piel, respondiendo a fuerzas de cizallamiento locales y deslizamientos incipientes o manifiestos dentro del campo receptivo. Los aferentes de Pacini son exquisitamente sensibles a los transitorios mecánicos rápidos. Los aferentes responden vigorosamente al soplo sobre el campo receptivo. Un corpúsculo de Pacini ubicado en un dedo generalmente responderá al tocar la mesa que sostiene el brazo. Los aferentes de Merkel característicamente tienen una alta sensibilidad dinámica a los estímulos de indentación aplicados a un área discreta y, a menudo, responden con una descarga externa durante la liberación. Aunque los aferentes de Ruffini responden a las fuerzas aplicadas normalmente a la piel, una característica única de los aferentes SA II es su capacidad para responder también al estiramiento lateral de la piel. Finalmente, las unidades de cabello en el antebrazo tienen grandes campos receptivos ovoides o irregulares compuestos por múltiples puntos sensibles que corresponden a cabellos individuales (cada suministro aferente ~20 cabellos).
Sensibilidad mecánica de los queratinocitos
Cualquier estímulo mecánico en la piel debe transmitirse a través de los queratinocitos que forman la epidermis. Estas células ubicuas pueden realizar funciones de señalización además de sus roles de apoyo o protección. Por ejemplo, los queratinocitos secretan ATP, una importante molécula de señalización sensorial, en respuesta a estímulos mecánicos y osmóticos.54,55 La liberación de ATP induce el aumento de calcio intracelular por estimulación autocrina de receptores purinérgicos.55 Además, hay evidencia de que la hipotonicidad activa la Rho-quinasa vía de señalización y la posterior formación de fibras de estrés F-actina que sugiere que la deformación mecánica de los queratinocitos puede interferir mecánicamente con las células vecinas, tales como células de Merkel para tacto inocuo y terminaciones libres de fibra C para contacto nocivo [Fig. 1 (C6)]. 56,57
Toque nocivo
Los mecanorreceptores de alto umbral (HTMR) son terminaciones nerviosas epidérmicas libres de C y Aδ. No se asocian a estructuras especializadas y se observan tanto en piel pilosa [fig. 1 (A9)] y piel glabra [Fig. 1(C7)]. Sin embargo, el término de terminación nerviosa libre debe considerarse con prudencia, ya que las terminaciones nerviosas siempre están en estrecha aposición con queratinocitos, células de Langheran o melanocitos. El análisis ultraestructural de las terminaciones nerviosas revela la presencia de retículo endoplásmico rugoso, abundantes mitocondrias y vesículas de núcleo denso. Las membranas adyacentes de las células epidérmicas están engrosadas y se asemejan a la membrana postsináptica en los tejidos nerviosos. Tenga en cuenta que las interacciones entre las terminaciones nerviosas y las células epidérmicas pueden ser bidireccionales, ya que las células epidérmicas pueden liberar mediadores como ATP, interleucina (IL6, IL10) y bradiquinina y, por el contrario, las terminaciones nerviosas peptidérgicas pueden liberar péptidos como CGRP o sustancia P que actúan sobre las células epidérmicas. Los HTMR comprenden mecano-nociceptores excitados solo por estímulos mecánicos nocivos y nociceptores polimodales que también responden al calor nocivo y a sustancias químicas exógenas [Fig. 2 (B2)].58
Las fibras aferentes de HTMR terminan en las neuronas de proyección en el asta dorsal de la médula espinal. Los Aδ-HTMR contactan con neuronas de segundo orden predominantemente en la lámina I y V, mientras que los C-HTMR terminan en la lámina II [Fig. 1 (B8)]. Las neuronas nociceptivas de segundo orden se proyectan hacia el lado contralateral de la médula espinal y ascienden en la sustancia blanca, formando el sistema anterolateral. Estas neuronas terminan principalmente en el tálamo [fig. 1 (B9 y B10)].
Mecano-corrientes en las neuronas somatosensoriales
Los mecanismos de adaptación lenta o rápida de mecanorreceptores aún no se han dilucidado. No está claro en qué medida la adaptación del mecanoreceptor es proporcionada por el entorno celular de la terminación del nervio sensorial, las propiedades intrínsecas de los canales con compuerta mecánica y las propiedades de los canales iónicos dependientes del voltaje axonal en las neuronas sensoriales (Fig. 2). Sin embargo, el progreso reciente en la caracterización de las corrientes mecánicamente cerradas ha demostrado que existen diferentes clases de canales mecanosensibles en las neuronas DRG y puede explicar algunos aspectos de la adaptación de los mecanorreceptores.
El registro in vitro en roedores ha demostrado que el soma de las neuronas del GRD es intrínsecamente mecanosensible y expresa corrientes mecanosensibles catiónicas. y benzamil, causan bloqueo parcial.59 FM64-60,62,63 actúa como un bloqueador duradero, y la inyección de FM1-43 en la pata trasera de ratones disminuye la sensibilidad al dolor en la prueba de Randall-Selitto y aumenta el umbral de retirada de la pata evaluada con pelos de von Frey.1
En respuesta a la estimulación mecánica sostenida, las corrientes mecanosensibles disminuyen a través del cierre. Con base en las constantes de tiempo de decaimiento de la corriente, se han distinguido cuatro tipos distintos de corrientes mecanosensibles: corrientes de adaptación rápida (~3–6 ms), corrientes de adaptación intermedia (~15–30 ms), corrientes de adaptación lenta (~200–300 ms). “1000 ms) y corrientes de adaptación ultralenta (~64 ms).64 Todas estas corrientes están presentes con incidencia variable en las neuronas DRG de rata que inervan la piel glabra de la pata trasera.XNUMX
La sensibilidad mecánica de las corrientes mecanosensibles se puede determinar mediante la aplicación de una serie de estímulos mecánicos incrementales, lo que permite un análisis estímulo-corriente relativamente detallado.66 La relación estímulo-corriente suele ser sigmoidal, y la amplitud máxima de la corriente está determinada por el número de canales que están abiertos simultáneamente.64,67 Curiosamente, se ha informado que la corriente mecanosensible de adaptación rápida muestra un umbral mecánico bajo y un punto medio de media activación en comparación con la corriente mecanosensible de adaptación ultralenta.63,65
Las neuronas sensoriales con fenotipos no nociceptivos expresan preferentemente corrientes mecanosensibles que se adaptan rápidamente con un umbral mecánico inferior.60,61,63,64,68 Por el contrario, ocasionalmente se informan corrientes mecanosensibles de adaptación lenta y ultra lenta en células putativas no nociceptivas.64,68 Esto sugirió que estas corrientes podrían contribuir a la diferentes umbrales mecánicos vistos en LTMRs e HTMRs in vivo. Aunque estos experimentos in vitro deben tomarse con precaución, el apoyo para la presencia en el soma de las neuronas DRG de mecanotransductores de bajo y alto umbral también fue proporcionado por la estimulación radial basada en estiramiento de neuronas sensoriales de ratón cultivadas.69 Este paradigma reveló dos poblaciones principales de neuronas sensibles al estiramiento, una que responde a la baja amplitud del estímulo y otra que responde selectivamente a la amplitud del estímulo alto.
Estos resultados tienen implicaciones mecanicistas importantes, aunque especulativas: el umbral mecánico de las neuronas sensoriales podría tener poco que ver con la organización celular del mecanorreceptor, pero puede estar en las propiedades de los canales iónicos de apertura mecánica.
Los mecanismos que subyacen a la desensibilización de las corrientes de cationes mecanosensibles en las neuronas DRG de rata se han desentrañado recientemente.64,67 Resulta de dos mecanismos concurrentes que afectan las propiedades del canal: adaptación e inactivación. La adaptación se informó por primera vez en estudios de células ciliadas auditivas. Puede describirse operativamente como una simple traslación de la curva de activación del canal del transductor a lo largo del eje del estímulo mecánico.70-72 La adaptación permite que los receptores sensoriales mantengan su sensibilidad a nuevos estímulos en presencia de un estímulo existente. Sin embargo, una fracción sustancial de las corrientes mecanosensibles en las neuronas DRG no se puede reactivar después de la estimulación mecánica acondicionadora, lo que indica la inactivación de algunos canales transductores.64,67 Por lo tanto, tanto la inactivación como la adaptación actúan en conjunto para regular las corrientes mecanosensibles. Estos dos mecanismos son comunes a todas las corrientes mecanosensibles identificadas en las neuronas DRG de rata, lo que sugiere que elementos fisicoquímicos relacionados determinan la cinética de estos canales.64
En conclusión, determinar las propiedades de las corrientes mecanosensibles endógenas in vitro es crucial en la búsqueda de identificar los mecanismos de transducción a nivel molecular. La variabilidad observada en el umbral mecánico y la cinética de adaptación de las diferentes corrientes activadas mecánicamente en las neuronas DRG sugieren que las propiedades intrínsecas de los canales iónicos pueden explicar, al menos en parte, el umbral mecánico y la cinética de adaptación de los mecanorreceptores descritos en las décadas de 1960. “80 usando preparaciones ex vivo.
Proteínas mecanorresensibles putativas
Las corrientes iónicas mecanosensibles en las neuronas somatosensoriales están bien caracterizadas, por el contrario, se sabe poco sobre la identidad de las moléculas que median la mecanotransducción en los mamíferos. Las pantallas genéticas en Drosophila y C. elegans han identificado moléculas de mecanotransducción candidatas, incluidas las familias TRP y degenerina / canal de Na + epitelial (Deg / ENaC). 73 Los recientes intentos de elucidar las bases moleculares de la mecanotransducción en mamíferos se han centrado principalmente en homólogos de estos candidatos . Además, muchos de estos candidatos están presentes en mecanoreceptores cutáneos y neuronas somatosensoriales (Fig. 2).
Canales iónicos sensibles al ácido
Los ASIC pertenecen a un subgrupo activado por protones de la familia de canales de Na+ epiteliales de degenerarina.74 Tres miembros de la familia ASIC (ASIC1, ASIC2 y ASIC3) se expresan en mecanorreceptores y nociceptores. El papel de los canales ASIC se ha investigado en estudios de comportamiento utilizando ratones con eliminación dirigida de genes de canales ASIC. La eliminación de ASIC1 no altera la función de los mecanorreceptores cutáneos, pero aumenta la sensibilidad mecánica de los aferentes que inervan el intestino.75 Los ratones knockout para ASIC2 exhiben una menor sensibilidad de los LTMR cutáneos de rápida adaptación.76 Sin embargo, estudios posteriores informaron una falta de efectos de la eliminación de ASIC2 en tanto la mecano-nocicepción visceral como la mecanosensación cutánea.77 La interrupción de ASIC3 disminuye la mecanosensibilidad de los aferentes viscerales y reduce las respuestas de los HTMR cutáneos a los estímulos nocivos.76
El canal del receptor transitorio
La superfamilia TRP se subdivide en seis subfamilias en mamíferos.78 Casi todas las subfamilias TRP tienen miembros vinculados a la mecanosensación en una variedad de sistemas celulares.79 En las neuronas sensoriales de mamíferos, sin embargo, los canales TRP son más conocidos por detectar información térmica e inducir la inflamación neurogénica. y solo dos canales TRP, TRPV4 y TRPA1, se han visto implicados en la respuesta táctil. La interrupción de la expresión de TRPV4 en ratones tiene solo efectos modestos sobre los umbrales mecanosensoriales agudos, pero reduce fuertemente la sensibilidad a estímulos mecánicos nocivos.80,81 TRPV4 es un determinante crucial en la formación de la respuesta de las neuronas nociceptivas al estrés osmótico y a la hiperalgesia mecánica durante la inflamación.82,83 TRPA1 parece tener un papel en la hiperalgesia mecánica. Los ratones con deficiencia de TRPA1 presentan hipersensibilidad al dolor. TRPA1 contribuye a la transducción de estímulos mecánicos, fríos y químicos en las neuronas sensoriales de nociceptores, pero parece que no es esencial para la transducción de células capilares.84,85
No hay pruebas claras que indiquen que los canales TRP y los canales ASIC expresados en mamíferos estén cerrados mecánicamente. Ninguno de estos canales expresados heterólogamente recapitula la firma eléctrica de las corrientes mecanosensibles observadas en su entorno nativo. Esto no excluye la posibilidad de que los canales ASIC y TRPs sean mecanotransductores, dada la incertidumbre de si un canal de mecanotransducción puede funcionar fuera de su contexto celular (ver la sección sobre SLP3).
Proteínas Piezo
Recientemente Coste y sus colaboradores identificaron a los piezo protiens como candidatos prometedores para la mecanización de proteínas. Los vertebrados 86,87 tienen dos miembros Piezo, Piezo 1 y Piezo 2, anteriormente conocidos como FAM38A y FAM38B, respectivamente, que están bien conservados a lo largo de eucariotas multicelulares. Piezo 2 es abundante en DRG, mientras que Piezo 1 apenas es detectable. Las corrientes mecanosensibles inducidas piezoeléctricas son inhibidas por gadolinio, rojo de rutenio y GsMTx4 (una toxina de la tarántula Grammostola spatulata) .88 La expresión de Piezo 1 o Piezo 2 en sistemas heterólogos produce corrientes mecanosensibles, la cinética de inactivación de la corriente Piezo 2 es más rápida que Piezo 1. De forma similar a las corrientes mecanosensibles endógenas, las corrientes dependientes de Piezo tienen potenciales de inversión alrededor de 0 mV y no son catiónicas selectivas, con Na +, K +, Ca2 + y Mg2 + que penetran todo el canal subyacente. Del mismo modo, las corrientes piezo-dependientes están reguladas por el potencial de membrana, con una marcada desaceleración de la cinética de la corriente en los potenciales despolarizados. 86
Las proteínas piezoeléctricas son, sin duda, mecanosensibles a las proteínas y comparten muchas propiedades de las corrientes mecanosensibles de rápida adaptación en las neuronas sensoriales. El tratamiento de neuronas DRG cultivadas con el ARN corto interferente Piezo 2 disminuyó la proporción de neuronas con corriente de adaptación rápida y disminuyó el porcentaje de neuronas mecanosensibles. Los dominios transmembrana 86 están ubicados en todas las proteínas piezoeléctricas pero no se han encontrado motivos evidentes que contengan poros o identificado. Sin embargo, la proteína Piezo 1 de ratón purificada y reconstituida en bicapas lipídicas asimétricas y liposoma forma canales iónicos sensibles al rojo de rutenio.87 Un paso esencial en la validación de la mecanotransducción a través de canales Piezo es utilizar enfoques in vivo para determinar la importancia funcional en la señalización táctil. Se proporcionó información en Drosophila donde la deleción del único miembro Piezo redujo la respuesta mecánica a estímulos nocivos, sin afectar el tacto normal.89 Aunque su estructura aún no se ha determinado, esta nueva familia de proteínas mecanosensibles es un tema prometedor para futuras investigaciones, más allá de la frontera de la sensación táctil Por ejemplo, un estudio reciente en pacientes con anemia (xerocitosis hereditaria) muestra el papel de Piezo 1 en el mantenimiento de la homeostasis del volumen de los eritrocitos. 90
Transmembrane Channel-Like (TMC)
Un estudio reciente indica que dos proteínas, TMC1 y TMC2, son necesarias para la mecanotransducción de células ciliadas.91 Se informó la sordera hereditaria debida a la mutación del gen TMC1 en humanos y ratones.92,93 La presencia de estos canales aún no se había mostrado en el sistema somatosensorial, pero parece ser una buena pista para investigar.
Proteína similar a Stomatin 3 (SLP3)
Además de los canales de transducción, algunas proteínas accesorias vinculadas al canal han demostrado tener un papel en la sensibilidad táctil. SLP3 se expresa en las neuronas DRG de mamíferos. Los estudios que utilizaron ratones mutantes que carecían de SLP3 habían mostrado cambios en la mecanosensación y las corrientes mechanosentive. La función precisa de 94,95 SLP3 permanece desconocida. Puede ser un enlazador entre el canal mecanosensible y los microtúbulos subyacentes, como se propuso para su homólogo de C. elegans MEC2.96 Recientemente GR. Lewin lab ha sugerido que las neuronas sensoriales DRG sintetizan una cadena y vincula el canal de ion mecanosensible a la matriz extracelular.97 La interrupción del enlace anula la corriente de mecanosensibilidad de la AR, lo que sugiere que algunos canales iónicos son mecanosensibles solo cuando están atados. Laminin-332, una proteína de matriz producida por los queratinocitos, también inhibe las corrientes mecanosensibles RA, lo que refuerza la hipótesis de una modulación de la corriente mecanosensible por proteínas extracelulares.98
Subfamilia de canales K +
Paralelamente a las corrientes mecánicas sensibles a la despolarización catiónica, se está investigando la presencia de corrientes repolarizantes de K + mecanosensibles. Los canales de K + en células mecanosensibles pueden avanzar en el equilibrio actual y contribuir a definir el umbral mecánico y el tiempo de adaptación de los mecanorreceptores.
Los miembros de KCNK pertenecen a la familia de K + channel de dominio de dos poros (K2P). 99,100 El K2P muestra un notable rango de regulación por agentes celulares, físicos y farmacológicos, que incluyen cambios de pH, calor, estiramiento y deformación de la membrana. Estos K2P son activos en el potencial de membrana en reposo. Varias subunidades de KCNK se expresan en neuronas somatosensoriales. Los canales 101 KCNK2 (TREK-1), KCNK4 (TRAAK) y TREK-2 se encuentran entre los pocos canales para los que se ha mostrado una sincronización mecánica directa por estiramiento de la membrana.102,103
Los ratones con un gen KCNK2 alterado mostraron una mayor sensibilidad al calor y a los estímulos mecánicos leves, pero un umbral de abstinencia normal a la presión mecánica nociva aplicada a la pata trasera mediante la prueba de Randall-Selitto.104 Los ratones con deficiencia de KCNK2 también muestran una mayor hiperalgesia térmica y mecánica en condiciones inflamatorias. Los ratones knockout para KCNK4 eran hipersensibles a la estimulación mecánica leve, y esta hipersensibilidad aumentó con la inactivación adicional de KCNK2.105 El aumento de la mecanosensibilidad de estos ratones knockout podría significar que el estiramiento normalmente activa corrientes mecanosensibles tanto despolarizantes como repolarizantes de manera coordinada, de manera similar al desequilibrio de Corrientes dependientes de voltaje despolarizantes y repolarizantes.
KCNK18 (TRESK) es un importante contribuyente a la conductancia de K+ de fondo que regula el potencial de reposo de la membrana de las neuronas somatosensoriales.106 Aunque no se sabe si KCNK18 es directamente sensible a la estimulación mecánica, puede jugar un papel en la mediación de las respuestas al tacto ligero, así como estímulos mecánicos dolorosos. Se propone que KCNK18 y, en menor medida, KCNK3, sean el objetivo molecular de hidroxi-α-sanshool, un compuesto que se encuentra en los granos de pimienta Schezuan que activa los receptores táctiles e induce una sensación de hormigueo en humanos.107,108
El canal K + dependiente de voltaje KCNQ4 (Kv7.4) es crucial para establecer la velocidad y preferencia de frecuencia de una subpoblación de mecanorreceptores de adaptación rápida tanto en ratones como en humanos. La mutación de KCNQ4 se ha asociado inicialmente con una forma de sordera hereditaria. Curiosamente, un estudio reciente localiza KCNQ4 en las terminaciones nerviosas periféricas del folículo capilar de adaptación rápida y el corpúsculo de Meissner. En consecuencia, la pérdida de la función KCNQ4 conduce a una mejora selectiva de la sensibilidad del mecanoreceptor a la vibración de baja frecuencia. Notablemente, las personas con pérdida auditiva de inicio tardío debido a mutaciones dominantes del gen KCNQ4 muestran un rendimiento mejorado en la detección de vibraciones de baja amplitud y amplitud pequeña. 109

Información del Dr. Alex Jiménez
El tacto es considerado como uno de los sentidos más complejos en el cuerpo humano, particularmente porque no hay un órgano específico a su cargo. En cambio, el sentido del tacto se produce a través de los receptores sensoriales, conocidos como mecanorreceptores, que se encuentran a través de la piel y responden a la presión mecánica o la distorsión. Hay cuatro tipos principales de mecanorreceptores en la piel glabra o lampiña de los mamíferos: corpúsculos lamelares, corpúsculos táctiles, terminaciones nerviosas de Merkel y corpúsculos bulbosos. Los mecanorreceptores funcionan para permitir la detección del tacto, con el fin de controlar la posición de los músculos, huesos y articulaciones, conocida como propiocepción, e incluso para detectar sonidos y el movimiento del cuerpo. Comprender los mecanismos de estructura y función de estos mecanorreceptores es un elemento fundamental en la utilización de tratamientos y terapias para el manejo del dolor.
Conclusión
El tacto es un sentido complejo porque representa diferentes cualidades táctiles, a saber, vibración, forma, textura, placer y dolor, con diferentes interpretaciones discriminatorias. Hasta ahora, la correspondencia entre un órgano táctil y el sentido psicofísico era correlativa y los marcadores moleculares específicos de cada clase están emergiendo. Ahora se requiere el desarrollo de pruebas de roedores que coincidan con la diversidad del comportamiento táctil para facilitar la futura identificación genómica. El uso de ratones que carecen de subconjuntos específicos de tipos aferentes sensoriales facilitará en gran medida la identificación de mecanoreceptores y fibras aferentes sensoriales asociadas con una modalidad de contacto particular. Curiosamente, un artículo reciente abre la importante cuestión de la base genética de los rasgos mecanosensoriales en humanos y sugiere que la mutación de un solo gen podría influir negativamente en la sensibilidad táctil. 110 Esto subraya que la fisiopatología del déficit táctil humano es en gran parte desconocida y sin duda progresa al identificar con precisión el subconjunto de neuronas sensoriales vinculadas a una modalidad táctil o un déficit táctil.
A cambio, se ha avanzado en la definición de las propiedades biofísicas de las corrientes mecanizadas. 64 El desarrollo de nuevas técnicas en los últimos años, que permiten controlar los cambios de tensión de la membrana, al registrar la corriente mecanizada, ha demostrado ser un método experimental valioso para describir corrientes mecanosensibles con adaptación rápida, intermedia y lenta (revisado en Delmas y colaboradores) .66,111 El futuro será determinar el papel de las propiedades actuales en los mecanismos de adaptación de mecanorreceptores funcionalmente diversos y la contribución de corrientes K + mecanosensibles a la excitabilidad de LTMR y HTMR.
La naturaleza molecular de las corrientes mecanizadas en los mamíferos también es un tema de investigación prometedor en el futuro. La investigación futura progresará en dos perspectivas, primero para determinar el papel de la molécula accesoria que une los canales al citoesqueleto y que se requerirá para conferir o regular la mecanosensibilidad de los canales iónicos de las familias TRP y ASIC / EnaC. Segundo, investigar el área grande y prometedora de la contribución de los canales Piezo respondiendo preguntas clave, relativas a los mecanismos de permeación y activación, el subconjunto de neuronas sensoriales y modalidades táctiles que involucran a Piezo y el papel de Piezo en células no neuronales asociadas con mecanosensación.
El sentido del tacto, en comparación con la vista, el gusto, el oído y el olfato, que utilizan órganos específicos para procesar estas sensaciones, puede ocurrir en todo el cuerpo a través de pequeños receptores conocidos como mecanorreceptores. Se pueden encontrar diferentes tipos de mecanorreceptores en varias capas de la piel, donde pueden detectar una amplia gama de estimulación mecánica. El artículo anterior describe aspectos destacados específicos que demuestran el progreso de los mecanismos estructurales y funcionales de los mecanorreceptores asociados con el sentido del tacto. Información referenciada del Centro Nacional de Información Biotecnológica (NCBI). El alcance de nuestra información se limita a la quiropráctica, así como a las lesiones y afecciones de la columna. Para hablar sobre el tema, no dude en preguntarle al Dr. Jiménez o contáctenos en 915-850-0900UNA .
Comisariada por el Dr. Alex Jiménez
1. Moriwaki K, Yuge O. Características topográficas de las anomalías hipoestésicas e hiperestésicas táctiles cutáneas en el dolor crónico. Dolor. 1999;81:1-6. doi: 10.1016/S0304-3959(98)00257-7. [PubMed] [Referencia cruzada]
2. Calce B, Kim DW, Kim BH, Nam TS, Leem JW, Chung JM. Sensibilización mecánica y térmica de nociceptores cutáneos en ratas con neuropatía periférica experimental. Neurociencia. 2005;132:193–201. doi: 10.1016/j.neurociencia.2004.12.036. [PubMed] [Referencia cruzada]
3. Kleggetveit IP, Jørum E. Disfunción de fibras grandes y pequeñas en lesiones de nervios periféricos con o sin dolor espontáneo. J Dolor. 2010;11:1305–10. doi: 10.1016/j.jpain.2010.03.004. [PubMed] [Referencia cruzada]
4. Sin espalda CR. Morfología y filogenia del cabello. Ann NY Acad Sci. 1951;53:476-92. doi: 10.1111/j.1749-6632.1951.tb31950.x. [PubMed] [Referencia cruzada]
5. Camino NOSOTROS. Folículos de pelo de guarda atípicos en la piel del conejo. Naturaleza. 1958; 181: 1604-5. doi: 10.1038/1811604a0. [PubMed] [Referencia cruzada]
6. Camino NOSOTROS. La morfología de los folículos tylotrich en la piel del conejo. Soy J Anat. 1961; 109: 1-13. doi: 10.1002/aja.1001090102. [PubMed] [Referencia cruzada]
7. Millard CL, Woolf CJ. Inervación sensorial de los pelos de la pata trasera de rata: un análisis microscópico de luz. J Comp Neurol. 1988;277:183-94. doi: 10.1002/cne.902770203. [PubMed] [Referencia cruzada]
8. Hamann W. Mecanorreceptores cutáneos de mamíferos. Prog Biophys Mol Biol. 1995;64:81-104. doi: 10.1016/0079-6107(95)00011-9. [Revisión] [PubMed] [Referencia cruzada]
9. Brown AG, Iggo A. Un estudio cuantitativo de receptores cutáneos y fibras aferentes en gatos y conejos. J Physiol. 1967; 193: 707-33. [Artículo gratuito de PMC] [PubMed]
10. Burgess PR, Petit D, Warren RM. Tipos de receptores en la piel peluda de los gatos suministrados por fibras mielinizadas. J Neurofisiol. 1968; 31:833-48. [PubMed]
11. Driskell RR, Giangreco A, Jensen KB, Mulder KW, Watt FM. Las células de la papila dérmica Sox2-positivas especifican el tipo de folículo piloso en la epidermis de los mamíferos. Desarrollo. 2009;136:2815–23. doi: 10.1242/dev.038620. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
12. Hussein MA. El patrón general de disposición del folículo piloso en la rata y el ratón. J Anat. 1971; 109: 307-16. [Artículo gratuito de PMC] [PubMed]
13. Vielkind U, Hardy MH. Cambios en los patrones de las moléculas de adhesión celular durante el desarrollo del folículo piloso del pelaje del ratón. 2. Morfogénesis del folículo en los mutantes de pelo Tabby y Downy. Acta Anat (Basilea) 1996;157:183–94. doi: 10.1159/000147880. [PubMed] [Referencia cruzada]
14. Hardy MH, Vielkind U. Cambios en los patrones de las moléculas de adhesión celular durante el desarrollo del folículo piloso del pelaje del ratón. 1. Morfogénesis del folículo en ratones de tipo salvaje. Acta Anat (Basilea) 1996;157:169–82. doi: 10.1159/000147879. [PubMed] [Referencia cruzada]
15. Li L, Rutlin M, Abraira VE, Cassidy C, Kus L, Gong S, et al. La organización funcional de las neuronas mecanosensoriales cutáneas de bajo umbral. Celúla. 2011;147:1615–27. doi: 10.1016/j.cell.2011.11.027. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
16. Brown AG, Iggo A. Un estudio cuantitativo de receptores cutáneos y fibras aferentes en gatos y conejos. J Physiol. 1967; 193: 707-33. [Artículo gratuito de PMC] [PubMed]
17. Burgess PR, Petit D, Warren RM. Tipos de receptores en la piel peluda de los gatos suministrados por fibras mielinizadas. J Neurofisiol. 1968; 31:833-48. [PubMed]
18. Vallbo A, Olausson H, Wessberg J, Norrsell U. Un sistema de aferentes amielínicas para la mecanorrecepción inocua en la piel humana. Res. cerebral. 1993;628:301-4. doi: 10.1016/0006-8993(93)90968-S. [PubMed] [Referencia cruzada]
19. Vallbo AB, Olausson H, Wessberg J. Los aferentes no mielinizados constituyen un segundo sistema que codifica los estímulos táctiles de la piel peluda humana. J Neurofisiol. 1999;81:2753–63. [PubMed]
20. Hertenstein MJ, Keltner D, App B, Bulleit BA, Jaskolka AR. El tacto comunica distintas emociones. Emoción. 2006;6:528–33. doi: 10.1037/1528-3542.6.3.528. [PubMed] [Referencia cruzada]
21. McGlone F, Vallbo AB, Olausson H, Loken L, Wessberg J. Toque discriminatorio y toque emocional. Can J Exp Psicol. 2007;61:173–83. doi: 10.1037/cjep2007019. [PubMed] [Referencia cruzada]
22. Wessberg J, Olausson H, Fernström KW, Vallbo AB. Propiedades de campo receptivo de aferentes táctiles amielínicas en la piel humana. J Neurofisiol. 2003;89:1567–75. doi: 10.1152/jn.00256.2002. [PubMed] [Referencia cruzada]
23. Liu Q, Vrontou S, Rice FL, Zylka MJ, Dong X, Anderson DJ. Visualización genética molecular de un raro subconjunto de neuronas sensoriales no mielinizadas que pueden detectar un toque suave. Nat Neurosci. 2007;10:946–8. doi: 10.1038/nn1937. [PubMed] [Referencia cruzada]
24. Olausson H, Lamarre Y, Backlund H, Morin C, Wallin BG, Starck G, et al. Los aferentes táctiles no mielinizados señalan el tacto y se proyectan a la corteza insular. Nat Neurosci. 2002;5:900–4. doi: 10.1038/nn896. [PubMed] [Referencia cruzada]
25. Olausson H, Wessberg J, Morrison I, McGlone F, Vallbo A. La neurofisiología de los aferentes táctiles no mielinizados. Neurosci Biobehav Rev. 2010;34:185–91. doi: 10.1016/j.neubiorev.2008.09.011. [Revisión] [PubMed] [Referencia cruzada]
26. Krämer HH, Lundblad L, Birklein F, Linde M, Karlsson T, Elam M, et al. Activación de la red de dolor cortical por estimulación táctil suave después de la inyección de sumatriptán. Dolor. 2007;133:72–8. doi: 10.1016/j.pain.2007.03.001. [PubMed] [Referencia cruzada]
27. Applebaum AE, Beall JE, Foreman RD, Willis WD. Organización y campos receptivos de las neuronas del tracto espinotalámico de primates. J Neurofisiol. 1975; 38: 572-86. [PubMed]
28. Blanco JC, Dulce WH. Efectividad de la cordotomía en el dolor fantasma después de la amputación. Psiquiatría AMA Arch Neurol. 1952;67:315-22. [PubMed]
29. Halata Z, Grim M, Bauman KI. Friedrich Sigmund Merkel y su "célula de Merkel", morfología, desarrollo y fisiología: revisión y nuevos resultados. Anat Rec A Discov Mol Cell Evol Biol. 2003;271:225–39. doi: 10.1002/ar.a.10029. [PubMed] [Referencia cruzada]
30. Morrison KM, Miesegaes GR, Lumpkin EA, Maricich SM. Las células de Merkel de mamíferos descienden del linaje epidérmico. Desarrollo Biol. 2009;336:76–83. doi: 10.1016/j.ydbio.2009.09.032. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
31. Van Keymeulen A, Mascre G, Youseff KK, Harel I, Michaux C, De Geest N, et al. Los progenitores epidérmicos dan lugar a las células de Merkel durante el desarrollo embrionario y la homeostasis adulta. J Cell Biol. 2009;187:91–100. doi: 10.1083/jcb.200907080. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
32. Ebara S, Kumamoto K, Baumann KI, Halata Z. Los análisis tridimensionales de las cúpulas táctiles en la piel peluda de la pata de gato revelan sustratos morfológicos para el procesamiento sensorial complejo. Neurosci Res. 2008;61:159–71. doi: 10.1016/j.neures.2008.02.004. [PubMed] [Referencia cruzada]
33. Guinard D, Usson Y, Guillermet C, Saxod R. Merkel complejos de piel digital humana: imágenes tridimensionales con microscopía láser confocal e inmunofluorescencia doble. J Comp Neurol. 1998;398:98-104. doi: 10.1002/(SICI)1096-9861(19980817)398:1<98::AID-CNE6>3.0.CO;2-4. [PubMed] [Referencia cruzada]
34. Reinisch CM, Tschachler E. La cúpula táctil en la piel humana es suministrada por diferentes tipos de fibras nerviosas. Ana Neurol. 2005;58:88–95. doi: 10.1002/ana.20527. [PubMed] [Referencia cruzada]
35. Maricich SM, Morrison KM, Mathes EL, Brewer BM. Los roedores confían en las células de Merkel para tareas de discriminación de texturas. J Neurosci. 2012;32:3296–300. doi: 10.1523/JNEUROSCI.5307-11.2012. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
36. Ikeda I, Yamashita Y, Ono T, Ogawa H. La destrucción fototóxica selectiva de las células de Merkel de rata suprime las respuestas de las unidades de mecanorreceptores de tipo I que se adaptan lentamente. J Physiol. 1994;479:247–56. [Artículo gratuito de PMC] [PubMed]
37. Maricich SM, Wellnitz SA, Nelson AM, Lesniak DR, Gerling GJ, Lumpkin EA, et al. Las células de Merkel son esenciales para las respuestas de toque ligero. Ciencia. 2009;324:1580–2. doi: 10.1126/ciencia.1172890. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
38. Diamond J, Holmes M, enfermera CA. ¿Están involucradas las sinapsis recíprocas de neuritas de células de Merkel en el inicio de las respuestas táctiles en la piel de salamandra? J Physiol. 1986;376:101-20. [Artículo gratuito de PMC] [PubMed]
39. Yamashita Y, Akaike N, Wakamori M, Ikeda I, Ogawa H. Corrientes dependientes del voltaje en células individuales aisladas de Merkel de ratas. J Physiol. 1992;450:143-62. [Artículo gratuito de PMC] [PubMed]
40. Wellnitz SA, Lesniak DR, Gerling GJ, Lumpkin EA. La regularidad del disparo sostenido revela dos poblaciones de receptores táctiles que se adaptan lentamente en la piel peluda del ratón. J Neurofisiol. 2010;103:3378–88. doi: 10.1152/jn.00810.2009. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
41. Nandasena BG, Suzuki A, Aita M, Kawano Y, Nozawa-Inoue K, Maeda T. Inmunolocalización de acuaporina-1 en las terminaciones mecanorreceptivas de Ruffini en el ligamento periodontal. Res. cerebral. 2007;1157:32–40. doi: 10.1016/j.brainres.2007.04.033. [PubMed] [Referencia cruzada]
42. Rahman F, Harada F, Saito I, Suzuki A, Kawano Y, Izumi K, et al. Detección del canal de iones de detección de ácido 3 (ASIC3) en las terminaciones periodontales de Ruffini de incisivos de ratón. Neurosci Lett. 2011;488:173–7. doi: 10.1016/j.neulet.2010.11.023. [PubMed] [Referencia cruzada]
43. Johnson KO. Los roles y funciones de los mecanorreceptores cutáneos. Curr Opinión Neurobiol. 2001;11:455–61. doi: 10.1016/S0959-4388(00)00234-8. [Revisión] [PubMed] [Referencia cruzada]
44. Wende H, Lechner SG, Cheret C, Bourane S, Kolanczyk ME, Pattyn A, et al. El factor de transcripción c-Maf controla el desarrollo y la función del receptor táctil. Ciencia. 2012;335:1373–6. doi: 10.1126/ciencia.1214314. [PubMed] [Referencia cruzada]
45. Mendelson M, Lowenstein WR. Mecanismos de adaptación del receptor. Ciencia. 1964; 144: 554-5. doi: 10.1126/ciencia.144.3618.554. [PubMed] [Referencia cruzada]
46. Loewenstein WR, Mendelson M. Componentes de la adaptación del receptor en un corpúsculo de Pacini. J Physiol. 1965; 177: 377-97. [Artículo gratuito de PMC] [PubMed]
47. Pawson L, Prestia LT, Mahoney GK, Güçlü B, Cox PJ, Pack AK. La interacción GABAérgica/glutamatérgica-glial/neuronal contribuye a la rápida adaptación en los corpúsculos de Pacini. J Neurosci. 2009;29:2695-705. doi: 10.1523/JNEUROSCI.5974-08.2009. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
48. Basbaum AI, Jessell TM. La percepción del dolor En: Kandel ER, Schwartz JH, Jessell TM, eds. Principios de la ciencia neuronal. Cuarta edición. Las compagias de McGraw-Hill, 2000: 472-490.
49. Bourane S, Garces A, Venteo S, Pattyn A, Hubert T, Fichard A, et al. Los subtipos de mecanorreceptores de umbral bajo expresan selectivamente MafA y se especifican mediante la señalización de Ret. Neurona. 2009;64:857–70. doi: 10.1016/j.neuron.2009.12.004. [PubMed] [Referencia cruzada]
50. Kramer I, Sigrist M, de Nooij JC, Taniuchi I, Jessell TM, Arber S. Un papel para la señalización del factor de transcripción Runx en la diversificación de neuronas sensoriales del ganglio de la raíz dorsal. Neurona. 2006;49:379–93. doi: 10.1016/j.neuron.2006.01.008. [PubMed] [Referencia cruzada]
51. Luo W, Enomoto H, Rice FL, Milbrandt J, Ginty DD. Identificación molecular de mecanorreceptores de rápida adaptación y su dependencia del desarrollo de la señalización ret. Neurona. 2009;64:841–56. doi: 10.1016/j.neuron.2009.11.003. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
52. Vallbo AB, Hagbarth KE. Actividad de los mecanorreceptores de la piel registrada percutáneamente en sujetos humanos despiertos. Exp. Neurol. 1968; 21:270-89. doi: 10.1016/0014-4886(68)90041-1. [PubMed] [Referencia cruzada]
53. Campo de mazas VG. Características fisiológicas de los mecanorreceptores de bajo umbral en articulaciones, músculos y piel en sujetos humanos. Clin Exp Pharmacol Physiol. 2005;32:135–44. doi: 10.1111/j.1440-1681.2005.04143.x. [Revisión] [PubMed] [Referencia cruzada]
54. Koizumi S, Fujishita K, Inoue K, Shigemoto-Mogami Y, Tsuda M, Inoue K. Las ondas de Ca2+ en los queratinocitos se transmiten a las neuronas sensoriales: la participación de la activación del receptor extracelular de ATP y P2Y2. Biochem J. 2004;380:329–38. doi: 10.1042/BJ20031089. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
55. Azorín N, Raoux M, Rodat-Despoix L, Merrot T, Delmas P, Crest M. La señalización de ATP es crucial para la respuesta de los queratinocitos humanos a la estimulación mecánica por choque hipoosmótico. Exp. Dermatol. 2011;20:401–7. doi: 10.1111/j.1600-0625.2010.01219.x. [PubMed] [Referencia cruzada]
56. Amano M, Fukata Y, Kaibuchi K. Regulación y funciones de la quinasa asociada a Rho. Res. celda exp. 2000;261:44–51. doi: 10.1006/excr.2000.5046. [Revisión] [PubMed] [Referencia cruzada]
57. Koyama T, Oike M, Ito Y. Participación de Rho-quinasa y tirosina quinasa en la liberación de ATP inducida por estrés hipotónico en células endoteliales aórticas bovinas. J Physiol. 2001;532:759–69. doi: 10.1111/j.1469-7793.2001.0759e.x. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
58. Perl ER. Receptores polimodales cutáneos: características y plasticidad. Prog Brain Res. 1996; 113: 21-37. doi: 10.1016/S0079-6123(08)61079-1. [Revisión] [PubMed] [Referencia cruzada]
59. McCarter GC, Reichling DB, Levine JD. Transducción mecánica por neuronas del ganglio de la raíz dorsal de rata in vitro. Neurosci Lett. 1999;273:179–82. doi: 10.1016/S0304-3940(99)00665-5. [PubMed] [Referencia cruzada]
60. Drew LJ, Wood JN, Cesare P. Distintas propiedades mecanosensibles de las neuronas sensoriales sensibles e insensibles a la capsaicina. J Neurosci. 2002; 22: RC228. [PubMed]
61. Drew LJ, Rohrer DK, Price MP, Blaver KE, Cockayne DA, Cesare P, et al. Los canales iónicos sensibles al ácido ASIC2 y ASIC3 no contribuyen a las corrientes activadas mecánicamente en las neuronas sensoriales de los mamíferos. J Physiol. 2004;556:691-710. doi: 10.1113/jfisiol.2003.058693. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
62. McCarter GC, Levine JD. Base iónica de una corriente de mecanotransducción en neuronas ganglionares de raíz dorsal de adulto. Mol Pain. 2006; 2: 28. doi: 10.1186 / 1744-8069-2-28. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
63. Coste B, Crest M, Delmas P. Disección farmacológica y distribución de NaN/Nav1.9, corrientes de Ca2+ tipo T y corrientes de cationes activados mecánicamente en diferentes poblaciones de neuronas DRG. J Gen Physiol. 2007;129:57–77. doi: 10.1085/jgp.200609665. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
64. Hao J, Delmas P. Múltiples mecanismos de desensibilización de los canales mecanotransductores dan forma al disparo de las neuronas mecanosensoriales. J Neurosci. 2010;30:13384–95. doi: 10.1523/JNEUROSCI.2926-10.2010. [PubMed] [Referencia cruzada]
65. Drew LJ, Wood JN. FM1-43 es un bloqueador permeable de los canales de iones mecanosensibles en las neuronas sensoriales e inhibe las respuestas conductuales a los estímulos mecánicos. Mol Pain. 2007; 3: 1. doi: 10.1186 / 1744-8069-3-1. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
66. Hao J, Delmas P. Grabación de corrientes mecanosensibles usando un mecanoestimulador piezoeléctrico. Protocolo Nat. 2011;6:979–90. doi: 10.1038/nprot.2011.343. [PubMed] [Referencia cruzada]
67. Rugiero F, Drew LJ, Wood JN. Propiedades cinéticas de corrientes activadas mecánicamente en neuronas sensoriales espinales. J Physiol. 2010;588:301–14. doi: 10.1113/jfisiol.2009.182360. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
68. HuJ, Lewin GR. Corrientes mecanosensibles en las neuritas de neuronas sensoriales de ratón cultivadas. J Physiol. 2006;577:815–28. doi: 10.1113/jfisiol.2006.117648. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
69. Bhattacharya MR, Bautista DM, Wu K, Haeberle H, Lumpkin EA, Julius D. El estiramiento radial revela distintas poblaciones de neuronas somatosensoriales de mamíferos mecanosensibles. Proc Natl Acad Sci US A. 2008;105:20015–20. doi: 10.1073/pnas.0810801105. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
70. Crawford AC, Evans MG, Fettiplace R. Activación y adaptación de corrientes transductoras en células ciliadas de tortuga. J Physiol. 1989;419:405-34. [Artículo gratuito de PMC] [PubMed]
71. Ricci AJ, Wu YC, Fettiplace R. El tampón de calcio endógeno y el curso temporal de la adaptación del transductor en las células ciliadas auditivas. J Neurosci. 1998;18:8261-77. [PubMed]
72. Vollrath MA, Kwan KY, Corey DP. La micromaquinaria de mecanotransducción en células ciliadas. Annu Rev Neurosci. 2007;30:339–65. doi: 10.1146/annurev.neuro.29.051605.112917. [Revisión] [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
73. Goodman MB, Schwarz EM. Toque transductor en Caenorhabditis elegans. Anu Rev Physiol. 2003;65:429–52. doi: 10.1146/annurev.fisiol.65.092101.142659. [Revisión] [PubMed] [Referencia cruzada]
74. Waldmann R, Lazdunski MH. Canales catiónicos activados por H(+): sensores de ácido neuronal en la familia de canales iónicos NaC/DEG. Curr Opinión Neurobiol. 1998;8:418–24. doi: 10.1016/S0959-4388(98)80070-6. [Revisión] [PubMed] [Referencia cruzada]
75. Page AJ, Brierley SM, Martin CM, Martinez-Salgado C, Wemmie JA, Brennan TJ, et al. El canal iónico ASIC1 contribuye a la función mecanorreceptora visceral pero no cutánea. Gastroenterología. 2004;127:1739-47. doi: 10.1053/j.gastro.2004.08.061. [PubMed] [Referencia cruzada]
76. Price MP, McIlwrath SL, Xie J, Cheng C, Qiao J, Tarr DE, et al. El canal catiónico DRASIC contribuye a la detección del tacto cutáneo y estímulos ácidos en ratones. Neurona. 2001;32:1071-83. doi: 10.1016/S0896-6273(01)00547-5. [Errata en: Neuron 2002 Jul 18;35] [2] [PubMed] [Referencia cruzada]
77. Roza C, Puel JL, Kress M, Baron A, Diochot S, Lazdunski M, et al. La eliminación del canal ASIC2 en ratones no afecta la mecanosensación cutánea, la mecanonocicepción visceral ni la audición. J Physiol. 2004;558:659–69. doi: 10.1113/jfisiol.2004.066001. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
78. Damn N, Voets T, Nilius B. TRP en nuestros sentidos. Curr Biol. 2008;18:R880–9. doi: 10.1016/j.cub.2008.07.063. [Revisión] [PubMed] [Referencia cruzada]
79. Christensen AP, Corey DP. Canales TRP en la mecanosensación: ¿activación directa o indirecta? Nat Rev Neurosci. 2007;8:510–21. doi: 10.1038/nrn2149. [Revisión] [PubMed] [Referencia cruzada]
80. Liedtke W, Tobin DM, Bargmann CI, Friedman JM. Mammalian TRPV4 (VR-OAC) dirige respuestas conductuales a estímulos osmóticos y mecánicos en Caenorhabditis elegans. Proc Natl Acad Sci US A. 2003;100(Suppl 2):14531–6. doi: 10.1073/pnas.2235619100. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
81. Suzuki M, Mizuno A, Kodaira K, Imai M. Sensación de presión alterada en ratones que carecen de TRPV4. J Biol Chem. 2003;278:22664–8. doi: 10.1074/jbc.M302561200. [PubMed] [Referencia cruzada]
82. Liedtke W, Choe Y, MartÃ-Renom MA, Bell AM, Denis CS, Sali A, et al. Canal activado osmóticamente relacionado con el receptor vaniloide (VR-OAC), un osmorreceptor vertebrado candidato. Celúla. 2000;103:525–35. doi: 10.1016/S0092-8674(00)00143-4. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
83. Alessandri-Haber N, Dina OA, Yeh JJ, Parada CA, Reichling DB, Levine JD. El receptor potencial transitorio vanilloid 4 es esencial en el dolor neuropático inducido por quimioterapia en la rata. J Neurosci. 2004;24:4444–52. doi: 10.1523/JNEUROSCI.0242-04.2004. [Errata en: J Neurosci. 2004 junio;24] [23] [PubMed] [Referencia cruzada]
84. Bautista DM, Jordt SE, Nikai T, Tsuruda PR, Read AJ, Poblete J, et al. TRPA1 media las acciones inflamatorias de irritantes ambientales y agentes proalgésicos. Celúla. 2006;124:1269–82. doi: 10.1016/j.cell.2006.02.023. [PubMed] [Referencia cruzada]
85. Kwan KY, Allchorne AJ, Vollrath MA, Christensen AP, Zhang DS, Woolf CJ, et al. TRPA1 contribuye a la nocicepción fría, mecánica y química, pero no es esencial para la transducción de células ciliadas. Neurona. 2006;50:277–89. doi: 10.1016/j.neurona.2006.03.042. [PubMed] [Referencia cruzada]
86. Coste B, Mathur J, Schmidt M, Earley TJ, Ranade S, Petrus MJ, et al. Piezo1 y Piezo2 son componentes esenciales de distintos canales catiónicos activados mecánicamente. Ciencia. 2010;330:55–60. doi: 10.1126/ciencia.1193270. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
87. Coste B, Xiao B, Santos JS, Syeda R, Grandl J, Spencer KS, et al. Las proteínas piezoeléctricas son subunidades formadoras de poros de canales activados mecánicamente. Naturaleza. 2012;483:176–81. doi: 10.1038/naturaleza10812. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
88. Bae C, Sachs F, Gottlieb PA. El canal iónico mecanosensible Piezo1 es inhibido por el péptido GsMTx4. Bioquímica. 2011;50:6295–300. doi: 10.1021/bi200770q. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
89. Kim SE, Coste B, Chadha A, Cook B, Patapoutian A. El papel de Drosophila Piezo en la nocicepción mecánica. Naturaleza. 2012;483:209–12. doi: 10.1038/naturaleza10801. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
90. Zarychanski R, Schulz VP, Houston BL, Maksimova Y, Houston DS, Smith B, et al. Las mutaciones en la proteína de mecanotransducción PIEZO1 están asociadas con la xerocitosis hereditaria. Sangre. 2012;120:1908–15. doi: 10.1182/sangre-2012-04-422253. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
91. Kawashima Y, Géléoc GS, Kurima K, Labay V, Lelli A, Asai Y, et al. La mecanotransducción en células ciliadas del oído interno de ratón requiere genes similares a canales transmembrana. J Clin Invest. 2011;121:4796–809. doi: 10.1172/JCI60405. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
92. Tlili A, Rebeh IB, Aifa-Hmani M, Dhouib H, Moalla J, Tlili-Chouchène J, et al. TMC1, pero no TMC2, es responsable de la discapacidad auditiva no sindrómica autosómica recesiva en las familias tunecinas. Audiol Neurool. 2008;13:213–8. doi: 10.1159/000115430. [PubMed] [Referencia cruzada]
93. Manji SS, Miller KA, Williams LH, Dahl HH. Identificación de tres nuevas cepas de ratones con pérdida auditiva con mutaciones en el gen Tmc1. Soy J Pathol. 2012;180:1560–9. doi: 10.1016/j.ajpath.2011.12.034. [PubMed] [Referencia cruzada]
94. Wetzel C, Hu J, Riethmacher D, Benckendorff A, Harder L, Eilers A, et al. Una proteína de dominio de estomatina esencial para la sensación táctil en el ratón. Naturaleza. 2007;445:206–9. doi: 10.1038/naturaleza05394. [PubMed] [Referencia cruzada]
95. Martinez-Salgado C, Benckendorff AG, Chiang LY, Wang R, Milenkovic N, Wetzel C, et al. Estomatina y mecanotransducción de neuronas sensoriales. J Neurofisiol. 2007;98:3802–8. doi: 10.1152/jn.00860.2007. [PubMed] [Referencia cruzada]
96. Huang M, Gu G, Ferguson EL, Chalfie M. Una proteína similar a la estomatina necesaria para la mecanosensación en C. elegans. Naturaleza. 1995;378:292–5. doi: 10.1038/378292a0. [PubMed] [Referencia cruzada]
97. Hu J, Chiang LY, Koch M, Lewin GR. Evidencia de una atadura de proteína involucrada en el toque somático. EMBO J. 2010;29:855–67. doi: 10.1038/emboj.2009.398. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
98. Chiang LY, Poole K, Oliveira BE, Duarte N, Sierra YA, Bruckner-Tuderman L, et al. Laminina-332 coordina la mecanotransducción y la bifurcación del cono de crecimiento en las neuronas sensoriales. Nat Neurosci. 2011;14:993–1000. doi: 10.1038/nn.2873. [PubMed] [Referencia cruzada]
99. Lesage F, Guillemare E, Fink M, Duprat F, Lazdunski M, Romey G, et al. TWIK-1, un canal de K+ rectificador débilmente interno humano ubicuo con una estructura novedosa. EMBO J. 1996;15:1004-11. [Artículo gratuito de PMC] [PubMed]
100. Lesage F. Farmacología de los canales de potasio de fondo neuronal. Neurofarmacología. 2003;44:1-7. doi: 10.1016/S0028-3908(02)00339-8. [Revisión] [PubMed] [Referencia cruzada]
101. Medhurst AD, Rennie G, Chapman CG, Meadows H, Duckworth MD, Kelsell RE, et al. Análisis de distribución de canales de potasio de dominio de dos poros humanos en tejidos del sistema nervioso central y periférico. Cerebro Res Mol Cerebro Res. 2001;86:101–14. doi: 10.1016/S0169-328X(00)00263-1. [PubMed] [Referencia cruzada]
102. Maingret F, Patel AJ, Lesage F, Lazdunski M, Honoré E. Mechano- o estimulación ácida, dos modos interactivos de activación del canal de potasio TREK-1. J Biol Chem. 1999;274:26691–6. doi: 10.1074/jbc.274.38.26691. [PubMed] [Referencia cruzada]
103. Maingret F, Fosset M, Lesage F, Lazdunski M, Honoré E. TRAAK es un canal de K+ activado por mecanismos neuronales de mamíferos. J Biol Chem. 1999;274:1381-7. doi: 10.1074/jbc.274.3.1381. [PubMed] [Referencia cruzada]
104. Alloui A, Zimmermann K, Mamet J, Duprat F, Noël J, Chemin J, et al. TREK-1, un canal de K+ implicado en la percepción polimodal del dolor. EMBO J. 2006;25:2368-76. doi: 10.1038/sj.emboj.7601116. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
105. Noël J, Zimmermann K, Busserolles J, Deval E, Alloui A, Diochot S, et al. Los canales de K+ activados mecánicamente TRAAK y TREK-1 controlan tanto la percepción cálida como la fría. EMBO J. 2009;28:1308–18. doi: 10.1038/emboj.2009.57. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
106. Dobler T, Springauf A, Tovornik S, Weber M, Schmitt A, Sedlmeier R, et al. Los canales de K+ de dominio de dos poros de TRESK constituyen un componente importante de las corrientes de potasio de fondo en las neuronas del ganglio de la raíz dorsal murina. J Physiol. 2007;585:867–79. doi: 10.1113/jfisiol.2007.145649. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
107. Bautista DM, Sigal YM, Milstein AD, Garrison JL, Zorn JA, Tsuruda PR, et al. Los agentes picantes de los pimientos de Szechuan excitan las neuronas sensoriales al inhibir los canales de potasio de dos poros. Nat Neurosci. 2008;11:772–9. doi: 10.1038/nn.2143. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
108. Lennertz RC, Tsunozaki M, Bautista DM, Stucky CL. Base fisiológica de la parestesia hormigueante provocada por hidroxi-alfa-sanshool. J Neurosci. 2010;30:4353–61. doi: 10.1523/JNEUROSCI.4666-09.2010. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
109. Heidenreich M, Lechner SG, Vardanyan V, Wetzel C, Cremers CW, De Leenheer EM, et al. Los canales KCNQ4 K(+) ajustan los mecanorreceptores para la sensación táctil normal en ratones y humanos. Nat Neurosci. 2012;15:138–45. doi: 10.1038/nn.2985. [PubMed] [Referencia cruzada]
110. Frenzel H, Bohlender J, Pinsker K, Wohlleben B, Tank J, Lechner SG, y col. Una base genética para los rasgos mecanosensoriales en humanos. PLoS Biol. 2012; 10: e1001318. doi: 10.1371 / journal.pbio.1001318. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada]
111. Delmas P, Hao J, Rodat-Despoix L. Mecanismos moleculares de mecanotransducción en neuronas sensoriales de mamíferos. Nat Rev Neurosci. 2011;12:139–53. doi: 10.1038/nrn2993. [PubMed] [Referencia cruzada]
Temas adicionales: Dolor de espalda
El dolor de espalda es una de las causas más frecuentes de discapacidad y días perdidos en el trabajo en todo el mundo. Como cuestión de hecho, el dolor de espalda se ha atribuido como la segunda razón más común para las visitas al consultorio médico, superado en número solo por las infecciones de las vías respiratorias superiores. Aproximadamente el 80% de la población experimentará algún tipo de dolor de espalda al menos una vez a lo largo de su vida. La columna vertebral es una estructura compleja compuesta por huesos, articulaciones, ligamentos y músculos, entre otros tejidos blandos. Debido a esto, lesiones y / o condiciones agravadas, como hernias discales, eventualmente puede conducir a síntomas de dolor de espalda. Las lesiones deportivas o las lesiones por accidentes automovilísticos suelen ser la causa más frecuente de dolor de espalda; sin embargo, a veces los movimientos más simples pueden tener resultados dolorosos. Afortunadamente, las opciones de tratamiento alternativo, como la atención quiropráctica, pueden ayudar a aliviar el dolor de espalda mediante el uso de ajustes espinales y manipulaciones manuales, mejorando finalmente el alivio del dolor.

TEMA EXTRA IMPORTANTE: Control del dolor en la parte inferior de la espalda
MÁS TEMAS: EXTRA EXTRA: Centro de atención del dolor crónico
Publicar descargos de responsabilidad
Alcance de la práctica profesional *
La información aquí contenida en "Mecanismos Estructurales y Funcionales de Mecanoreceptores" no pretende reemplazar una relación personal con un profesional de la salud calificado o un médico con licencia y no es un consejo médico. Lo alentamos a que tome decisiones de atención médica basadas en su investigación y asociación con un profesional de la salud calificado.
Información del blog y debates sobre el alcance
Nuestro alcance informativo se limita a la quiropráctica, musculoesquelética, medicina física, bienestar, contribuyendo etiológico alteraciones viscerosomáticas dentro de las presentaciones clínicas, la dinámica clínica del reflejo somatovisceral asociado, los complejos de subluxación, los problemas de salud delicados y/o los artículos, temas y debates de medicina funcional.
Brindamos y presentamos colaboración clínica con especialistas de diversas disciplinas. Cada especialista se rige por su ámbito de práctica profesional y su jurisdicción de licencia. Utilizamos protocolos funcionales de salud y bienestar para tratar y apoyar la atención de lesiones o trastornos del sistema musculoesquelético.
Nuestros videos, publicaciones, temas, asuntos e ideas cubren cuestiones clínicas, problemas y temas que se relacionan y respaldan directa o indirectamente nuestro ámbito de práctica clínica.*
Nuestra oficina ha intentado razonablemente proporcionar citas de apoyo y ha identificado el estudio o los estudios de investigación relevantes que respaldan nuestras publicaciones. Proporcionamos copias de los estudios de investigación de respaldo disponibles para las juntas reguladoras y el público a pedido.
Entendemos que cubrimos asuntos que requieren una explicación adicional de cómo puede ayudar en un plan de atención o protocolo de tratamiento en particular; por lo tanto, para discutir más a fondo el tema anterior, no dude en preguntar Dr. Alex Jiménez, DC, o póngase en contacto con nosotros en 915-850-0900.
Estamos aquí para ayudarlo a usted y a su familia.
Bendiciones
El Dr. Alex Jimenez corriente continua MSACP, enfermero*, CCCT, IFMCP*, CIFM*, ATN*
email: coach@elpasomedicinafuncional.com
Licenciado como Doctor en Quiropráctica (DC) en Texas & New Mexico*
Número de licencia de Texas DC TX5807, Nuevo México DC Número de licencia NM-DC2182
Licenciada como Enfermera Registrada (RN*) en Florida
Licencia de Florida N.° de licencia de RN RN9617241 (Control No. 3558029)
Estado compacto: Licencia multiestatal: Autorizado para ejercer en 40 Estados*
Matriculado actualmente: ICHS: MSN* FNP (Programa de enfermera practicante familiar)
Dr. Alex Jiménez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Mi tarjeta de presentación digital







 De nuevo te doy la bienvenida.
De nuevo te doy la bienvenida.
Los comentarios están cerrados.