Epigenético: Existe una fina interacción entre la experiencia sensorial y los programas genéticos innatos que conducen a la escultura de los circuitos neuronales durante el desarrollo temprano del cerebro. La evidencia reciente sugiere que la regulación dinámica de la expresión génica a través de mecanismos epigenéticos se encuentra en la interfaz entre los estímulos ambientales y los fenotipos de comportamiento molecular, celular y complejos de larga duración adquiridos durante los períodos de plasticidad del desarrollo. Comprender estos mecanismos puede dar una idea de la formación de períodos críticos y proporcionar nuevas estrategias para aumentar la plasticidad y el cambio adaptativo en la edad adulta.
Introducción
Durante el desarrollo temprano, se crean circuitos neuronales y las conexiones entre las neuronas experimentan remodelación a medida que desarrollan sus propiedades funcionales adultas en respuesta al entorno circundante. El cerebro adulto pierde esta plasticidad extraordinaria. Los hallazgos recientes respaldan un papel clave de factores epigenéticos en la mediación de los efectos de la experiencia sensorial en la expresión génica específica del sitio, la transmisión sináptica y los fenotipos conductuales. Aquí revisamos evidencia reciente que implica múltiples mecanismos epigenéticos en cambios dependientes de la experiencia durante el desarrollo y discutimos su papel en la expresión del período crítico en el cerebro adulto y en desarrollo.
Epigenética: mecanismos moleculares de regulación genética
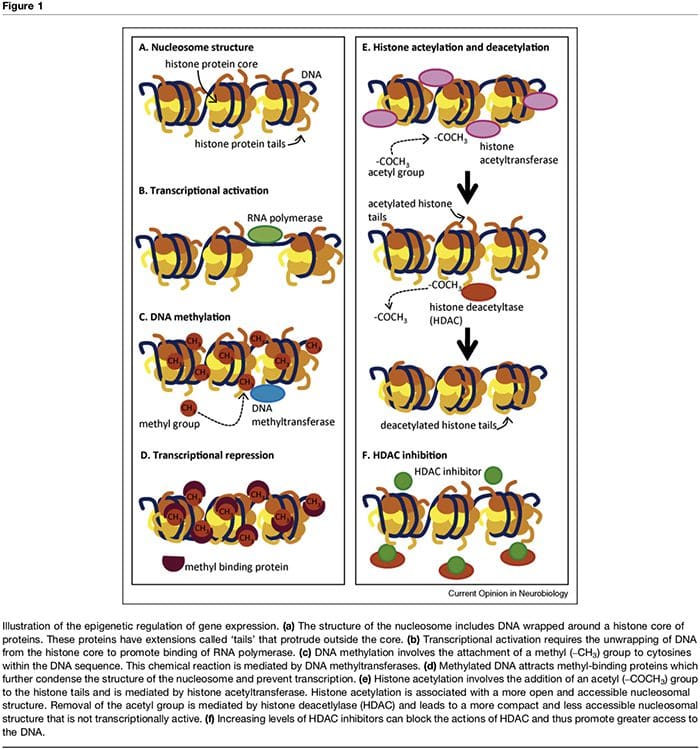
El término 'epigenética' se refiere a las modificaciones de la cromatina que alteran la expresión génica sin afectar la secuencia de ADN. Los factores que contribuyen a la regulación epigenética de la actividad transcripcional son numerosos e incluyen microARN [1], metilación del ADN [2,3] y modificaciones postraduccionales de las histonas nucleosómicas [2,4]. La metilación del ADN se refiere a una modificación química del ADN mediante la cual la citosina se convierte en 5-metilcitosina con la consecuencia de una accesibilidad reducida del ADN a los factores de transcripción (Figura 1a-d). Estas modificaciones pueden ser estables y hereditarias y proporcionar un mecanismo crítico en la diferenciación celular [3]. El proceso de metilación depende de la presencia de donantes de metilo (proporcionados por nutrientes como ácido fólico, metionina y colina) y metiltransferasas que median en el mantenimiento (es decir, DNMT1) o en la metilación del ADN de novo (es decir, DNMT3). La represión transcripcional asociada con la metilación del ADN se mantiene aún más a través de proteínas de unión a metilo como MeCP2 [5]. El control epigenético de la expresión génica también está mediado por múltiples modificaciones postraduccionales de las proteínas histonas, incluidas la metilación, la acetilación y la ubiquinación, que pueden alterar la accesibilidad del ADN y la densidad de la estructura de la cromatina (Figura 1e,f). En particular, la acetilación de histonas se asocia con una mayor actividad transcripcional, mientras que la desacetilación de histonas se asocia con una represión transcripcional. El estado de acetilación de estas proteínas nucleosómicas está controlado por la presencia de histonas acetiltransferasas (HAT), histonas desacetilasas (HDAC), que son reclutadas por proteínas de unión a metilo, y por inhibidores de HDAC, que aumentan efectivamente la expresión génica al cambiar las histonas a un acetilado. estado [2,6]. El momento y el grado de expresión génica se controlan a través de estos mecanismos complejos, lo que proporciona un vínculo entre los genotipos únicos y los fenotipos múltiples.
Factores epigenéticos y la influencia de las experiencias de la vida temprana
En el desarrollo de mamíferos, los períodos prenatales y posnatales se caracterizan por cambios rápidos en la organización neuronal, proporcionando así una ventana de oportunidad crítica durante la cual las experiencias ambientales pueden conducir a influencias a largo plazo sobre el cerebro y el comportamiento. Cada vez hay más pruebas del papel de los factores epigenéticos en la mediación de la relación entre estas experiencias y los resultados a largo plazo. Mueller y Bale [7] han demostrado recientemente la disminución de la metilación del ADN del promotor del gen corticotrophin-releasing factor (CRF) y el aumento de la metilación del receptor del glucocorticoide (GR) exón 17 región promotora en el tejido hipotalámico de ratones machos adultos nacidos de hembras gestacionalmente estresados . Estas modificaciones epigenéticas están asociadas con la exposición al estrés durante las primeras etapas del desarrollo prenatal y pueden implicar la desregulación de la expresión génica placentaria. los nutricional también se ha demostrado que el entorno durante el desarrollo fetal influye en el crecimiento, el metabolismo y el desarrollo cerebral, y cada vez hay más pruebas de que los niveles dietéticos de los donantes de metilo pueden alterar epigenéticamente la expresión génica en la descendencia [8,9]. En ratas, Lillycrop et al. [10] ilustra que la metilación del promotor del gen GR 110 y PPARa (receptor alfa activado por proliferador de peroxisoma) se reduce en el tejido hepático de descendientes nacidos de madres con proteínas restringidas, mientras que la metilación aumenta en descendientes de madres cuya dieta se complementa con donantes de metilo [10,11 ] Estos efectos pueden estar relacionados con la expresión DNMT1, que también se reduce con la restricción de proteínas dietéticas [11]. La regulación nutricional prenatal de la metilación del ADN se ha observado en tejido cerebral asociado con niveles de expresión DNMT1 [12], sugiriendo que en el período rápido de división celular que ocurre durante el desarrollo fetal, el nivel de donantes de metilo puede tener un impacto significativo en la actividad transcripcional eso se mantiene en la edad adulta.
 El papel de la modificación epigenética en el mantenimiento de los efectos de la experiencia ambiental también se ha demostrado en el contexto de las interacciones postnatales madre-bebé. Las variaciones individuales en el cuidado materno durante el período posparto inmediato en ratas están asociadas con cambios en la actividad del hipotálamo-pituitario-suprarrenal (HPA) de la descendencia, los sistemas neuroendocrinos involucrados en la reproducción y la plasticidad del hipocampo [13]. Los análisis de los niveles de metilación del promotor dentro del GR 17 del hipocampo y los genes ERa hipotalámicos en crías de madres de ratas que brindan niveles altos versus bajos de cuidado materno indican que los niveles altos de cuidado están asociados con una disminución de la metilación del promotor y, por lo tanto, una mayor expresión génica [14,15, 17]. Aunque la ruta a través de la cual estos cambios epigenéticos están mediados aún no está clara, existe evidencia de una mayor unión de la proteína A inducible por el factor de crecimiento nervioso (NGFI-A) al promotor GR exón 15 entre los descendientes que reciben altos niveles de atención en la infancia [17] y los modelos in vitro sugieren que la regulación positiva de NGFI-A está asociada con la acetilación de histonas, la desmetilación del ADN y la activación del promotor GR del exón 16 [17]. La relevancia de estos efectos en humanos ha sido demostrada recientemente por Oberlander et al. [1] en el análisis del estado de metilación del promotor GR en los sitios de unión de NGFI-A en células mononucleares de sangre de cordón umbilical de bebés expuestos a un estado de ánimo depresivo o ansioso materno en el tercer trimestre. Se encontró que la depresión materna estaba asociada con un aumento de la metilación del promotor GR 3F en muestras de sangre fetal y estos patrones de metilación predijeron la reactividad del HPA en bebés a los 17 meses de edad [1]. El análisis del tejido del hipocampo de víctimas de suicidio con antecedentes de abuso infantil indica de manera similar una expresión de GR más baja y una metilación del promotor de GR 18F más alta asociada con alteraciones del entorno temprano y confirma los hallazgos de estudios con roedores de que la unión diferencial de NGFI-A es una consecuencia funcional de estos efectos epigenéticos [19]. Sin embargo, el impacto de las interacciones perinatales madre-bebé no se limita a la regulación de GR, como lo ilustran Roth et al. [19] examinando los efectos del abuso posnatal en la metilación del factor neurotrófico derivado del cerebro (BDNF) [1]. En ratas, se encontró un aumento en la metilación del exón IV del promotor BDNF y la consiguiente disminución del ARNm de BDNF en la corteza prefrontal en asociación con la exposición a períodos de cuidado materno abusivo (arrastrar, manipular bruscamente, etc.). Como sucedió con los efectos de las diferencias individuales en el cuidado materno, estos efectos surgieron en la infancia y se mantuvieron hasta la edad adulta. Además, estos efectos sobre la metilación del exón IV del BDNF se perpetúan en la generación F20, lo que sugiere un papel de los mecanismos epigenéticos en los efectos transgeneracionales [XNUMX].
El papel de la modificación epigenética en el mantenimiento de los efectos de la experiencia ambiental también se ha demostrado en el contexto de las interacciones postnatales madre-bebé. Las variaciones individuales en el cuidado materno durante el período posparto inmediato en ratas están asociadas con cambios en la actividad del hipotálamo-pituitario-suprarrenal (HPA) de la descendencia, los sistemas neuroendocrinos involucrados en la reproducción y la plasticidad del hipocampo [13]. Los análisis de los niveles de metilación del promotor dentro del GR 17 del hipocampo y los genes ERa hipotalámicos en crías de madres de ratas que brindan niveles altos versus bajos de cuidado materno indican que los niveles altos de cuidado están asociados con una disminución de la metilación del promotor y, por lo tanto, una mayor expresión génica [14,15, 17]. Aunque la ruta a través de la cual estos cambios epigenéticos están mediados aún no está clara, existe evidencia de una mayor unión de la proteína A inducible por el factor de crecimiento nervioso (NGFI-A) al promotor GR exón 15 entre los descendientes que reciben altos niveles de atención en la infancia [17] y los modelos in vitro sugieren que la regulación positiva de NGFI-A está asociada con la acetilación de histonas, la desmetilación del ADN y la activación del promotor GR del exón 16 [17]. La relevancia de estos efectos en humanos ha sido demostrada recientemente por Oberlander et al. [1] en el análisis del estado de metilación del promotor GR en los sitios de unión de NGFI-A en células mononucleares de sangre de cordón umbilical de bebés expuestos a un estado de ánimo depresivo o ansioso materno en el tercer trimestre. Se encontró que la depresión materna estaba asociada con un aumento de la metilación del promotor GR 3F en muestras de sangre fetal y estos patrones de metilación predijeron la reactividad del HPA en bebés a los 17 meses de edad [1]. El análisis del tejido del hipocampo de víctimas de suicidio con antecedentes de abuso infantil indica de manera similar una expresión de GR más baja y una metilación del promotor de GR 18F más alta asociada con alteraciones del entorno temprano y confirma los hallazgos de estudios con roedores de que la unión diferencial de NGFI-A es una consecuencia funcional de estos efectos epigenéticos [19]. Sin embargo, el impacto de las interacciones perinatales madre-bebé no se limita a la regulación de GR, como lo ilustran Roth et al. [19] examinando los efectos del abuso posnatal en la metilación del factor neurotrófico derivado del cerebro (BDNF) [1]. En ratas, se encontró un aumento en la metilación del exón IV del promotor BDNF y la consiguiente disminución del ARNm de BDNF en la corteza prefrontal en asociación con la exposición a períodos de cuidado materno abusivo (arrastrar, manipular bruscamente, etc.). Como sucedió con los efectos de las diferencias individuales en el cuidado materno, estos efectos surgieron en la infancia y se mantuvieron hasta la edad adulta. Además, estos efectos sobre la metilación del exón IV del BDNF se perpetúan en la generación F20, lo que sugiere un papel de los mecanismos epigenéticos en los efectos transgeneracionales [XNUMX].
Desarrollo a lo largo de la vida: epigenética y plasticidad dependiente de la experiencia
La sección anterior resalta los efectos estables de las experiencias tempranas de la vida y cómo estos eventos se codifican a nivel molecular. Otro enfoque para el estudio de la epigenética y el desarrollo proviene de los estudios de plasticidad sináptica durante la expresión de la potenciación a largo plazo (LTP) y la consolidación de la memoria. Se ha demostrado que los altos niveles de cuidado materno y la exposición al enriquecimiento ambiental juvenil (EE) mejoran la capacidad para el aprendizaje y la memoria asociados con la mejora del LTP [21,22]. Además, la evidencia reciente sugiere que EE modula las vías de señalización NMDAr / p38 / LTP en el hipocampo y mejora la formación de memoria de miedo contextual a través de generaciones, de modo que la descendencia de madres enriquecidas también muestra una LTP mejorada incluso cuando son cruzadas en el nacimiento con madres no enriquecidas [23 ] El enriquecimiento ambiental se ha asociado con una mayor acetilación de histonas en el hipocampo y una mejor memoria espacial [24,25]. El objetivo farmacológico del epigenoma se ha usado para demostrar el papel de la acetilación de histonas y la metilación del ADN en la consolidación de la memoria a largo plazo [26]. Se ha demostrado que el tratamiento con zebularina (un inhibidor o ADN metiltransferasas) bloquea la formación de memoria y reduce la acetilación de histonas después del acondicionamiento de miedo en ratas adultas [27], mientras que el tratamiento con inhibidor de HDAC con butirato sódico mejora la formación de recuerdos contextuales de miedo [ 28]. El objetivo particular de HDAC de estos inhibidores puede ser HDAC2 a medida que ha surgido evidencia reciente que ilustra la disminución de la plasticidad sináptica y la formación de memoria en ratones que sobreexpresan HDAC2 pero no HDAC1; con el efecto inverso en ratones deficientes en HDAC2 [29]. Estos estudios ilustran una posible relación entre la actividad sináptica y la metilación de la histona / metilación del ADN en neuronas maduras, lo que sugiere que hay una plasticidad continua en estos sistemas epigenéticos más allá de los períodos de desarrollo prenatal y postnatal.
Mecanismo epigenético y regulación de la transmisión sináptica
Los cambios dependientes de la actividad en la expresión génica dentro de las vías neuronales durante el desarrollo pueden servir como una vía crítica que vincula la experiencia del entorno externo y las modificaciones epigenéticas dentro del núcleo celular. En un estudio reciente, Monteggia y sus colegas demostraron elegantemente que la transmisión sináptica espontánea en las neuronas del hipocampo está regulada por alteraciones en la metilación del ADN que ocurren en respuesta a la actividad sináptica [30]. El tratamiento con un inhibidor de DNMT condujo a una disminución significativa en la frecuencia de corrientes postsinápticas excitatorias en miniatura (mEPSC) y la tasa de fusión de vesículas sinápticas espontáneas se correlacionó con una disminución en la metilación del promotor I de BDNF y una mayor expresión de BDNF. Este efecto se bloqueó con la inhibición de la actividad sináptica y se evitaron reducciones en mEPSC en ausencia de MeCP2. Estos resultados sugieren fuertemente un papel para la metilación del ADN / MeCP2 vías en el control de la función sináptica. Se ha demostrado que la fosforilación dependiente de la actividad de MeCP2 a través de Ca2 + -calmodulindependent kinase II causa la disociación de MeCP2 de genes diana y alivia la represión transcripcional [31]. En consecuencia, los genes tales como BDNF se incrementan en la expresión que conduce a patrones dendríticos normales y desarrollo de la espina dendrítica [32]. Estos hallazgos sugieren un mecanismo epigenético a través del cual las neuronas pueden monitorear las alteraciones en el nivel de actividad y ajustar la producción de neurotransmisores a través de la expresión génica alterada con consecuencias para la excitabilidad de la red y el refinamiento del circuito. Las deficiencias en estas vías MeCP2 pueden conducir a varias anomalías del neurodesarrollo como el síndrome de Rett, autismo infantil, retraso mental y esquizofrenia [33] y se ha demostrado recientemente que la deleción dirigida de MeCP2 en la amígdala afecta el aprendizaje y la memoria y aumenta la ansiedad. comportamiento en ratones [34].
Control epigenético de la plasticidad del período crítico
Aunque los mecanismos epigenéticos ciertamente han estado implicados en la mediación de los altos niveles de plasticidad en el desarrollo temprano, también es posible ver la disminución de la plasticidad y la sensibilidad que ocurre más tarde en el desarrollo desde una perspectiva epigenética. Los circuitos neocorticales son extremadamente sensibles a las manipulaciones del entorno sensorial durante las ventanas temporales restringidas del desarrollo posnatal denominadas "períodos críticos". Por ejemplo, un desequilibrio en la visión binocular durante la niñez afecta la percepción y conduce a la ambliopÃa u “ojo perezoso†. La privación monocular (DM) reproduce este paradigma clásico de plasticidad dependiente de la experiencia [35]. El sorprendente efecto fisiológico de MD es un cambio en la respuesta de las neuronas corticales visuales a favor del ojo no privado; un ejemplo de plasticidad de dominancia ocular (OD). El período crítico durante el cual se produce esta plasticidad de la DO se define por la activación y posterior inhibición de vías moleculares específicas que implican moléculas de señalización como aCaMKII, calcineurina, PKA, ERK y CREB [36]. Recientemente, Pizzorusso y sus colegas identificaron aumentos rápidos en la fosforilación de histonas dependiente de ERK asociados con la activación de la corteza visual juvenil y una regulación a la baja del desarrollo de este efecto en ratones más viejos [37]. En ratones adultos, la plasticidad OD reducida se puede restablecer mediante el tratamiento con el inhibidor de HDAC tricostatina A (TSA). Múltiples mecanismos celulares podrían contribuir a la expresión de la plasticidad dependiente de la experiencia [38]. Se necesita más trabajo para comprender si los mecanismos epigenéticos generalmente actúan en todos los sustratos celulares o solo dentro de un subconjunto específico.
La maduración de la mielina también se ha propuesto como uno de los principales factores que contribuyen a la disminución de la plasticidad neuronal. Durante el inicio de la plasticidad del período crítico, los oligodendrocitos comienzan a expresar proteínas estructurales de mielina específicas, incluida la proteína básica de mielina (MBP), la glicoproteína asociada a mielina (MAG), la glicoproteína de oligodendrocitos de mielina (OMgp) y la proteína básica de oligodendrocitos asociada a mielina (MOBP). 39]. A medida que la mielinización alcanza los niveles de los adultos, la plasticidad del OD se reduce considerablemente o desaparece. MAG y OMgp pueden contribuir al cierre del período crítico mediante la activación de los receptores Nogo. De hecho, los ratones que carecen de receptores Nogo exhiben plasticidad OD incluso en la edad adulta [40]. La manipulación del estado epigenético de los oligodendrocitos también puede ser una estrategia eficaz para modular la plasticidad. Casaccia-Bonnefil y sus colegas han demostrado que las modificaciones de histonas están involucradas en la diferenciación de células precursoras de oligodendrocitos (OPC) durante el desarrollo y en la recuperación de una lesión [41-43]. Se encontró que la administración del ácido valproico inhibidor de HDAC durante el período crítico del inicio de la mielinización previene la maduración de OPC en células mielinizantes. Estos resultados sugieren que la actividad HDAC durante una ventana temporal específica del desarrollo posnatal es necesaria para la diferenciación y mielinización de OPC. En etapas posteriores del desarrollo, la desacetilación de las histonas disminuye y es reemplazada por la metilación represiva de las histonas y el establecimiento de una estructura de cromatina compacta, característica del fenotipo de oligodendrocitos diferenciados [43]. Shen et al. [44] encontraron que, en respuesta al daño de los oligodendrocitos, se produjo una fuerte remielinización en los animales jóvenes pero no en los más viejos con la nueva síntesis de mielina precedida por la regulación negativa de los inhibidores de la diferenciación de oligodendrocitos y los marcadores de células madre neurales y el reclutamiento de HDAC en las regiones promotoras. Este reclutamiento de HDAC es ineficiente en cerebros más viejos, lo que permite la acumulación de inhibidores transcripcionales y la prevención de la expresión del gen de la mielina. Este efecto dependiente de la edad se puede inducir en ratones jóvenes tratados con inhibidores de HDAC durante el período en que se produce el daño a los oligodentrocitos. Así, hay cambios epigenéticos que son característicos de los períodos de plasticidad del desarrollo que podrían proporcionar un objetivo para la intervención terapéutica en caso de daño del SNC. El uso de inhibidores de HDAC para aumentar la plasticidad en el cerebro puede ser un enfoque terapéutico prometedor, ya que existe evidencia convergente de modelos de roedores de que el tratamiento con estos compuestos (1) puede conducir a cambios dramáticos en la expresión génica y el comportamiento en la descendencia adulta que tiene recibieron bajos niveles de atención materna [15] y (2) imitan los efectos de EE en la reversión de anomalías del desarrollo neurológico [24]. En lugar de producir un aumento generalizado en la transcripción, estos compuestos conducen a la activación de un subconjunto específico de genes [45–47], lo que sugiere una posible intervención dirigida para restablecer la plasticidad en el cerebro adulto.
Conclusiones
Hay pruebas convergentes del papel de las modificaciones epigenéticas, como la acetilación de histonas y la metilación del ADN, tanto en la estabilidad como en la plasticidad de los circuitos neuronales en desarrollo. Los efectos persistentes sobre la expresión génica que se pueden lograr a través de estos mecanismos proporcionan una ruta biológica a través de la cual las experiencias ambientales pueden integrarse, lo que lleva a cambios a largo plazo en la neurobiología y el comportamiento. Mejorar la plasticidad en el cerebro adulto es una perspectiva emocionante y ciertamente está surgiendo evidencia que sugiere el posible uso de factores epigenéticos para inducir un cerebro "más joven". El desafío de los estudios futuros es establecer las vías a través de las cuales se pueden lograr modificaciones transcripcionales específicas del sitio y del gen y comprender mejor la ruta a través de la cual las experiencias a lo largo de la vida inducen esta plasticidad molecular.
Michela Fagiolini 1, Catherine L Jensen 2 y Frances A Champagne 2
Opinión actual en neurobiología 2009, 19: 1-6
Esta revisión proviene de un tema temático sobre Desarrollo
Editado por Takao Hensch y Andrea Brand
0959-4388/$ – ver portada Publicado por Elsevier Ltd.
DOI 10.1016 / j.conb.2009.05.009
Autor para correspondencia: Champagne, Frances A (fac2105@columbia.edu)
1. Mattick JS, PP Amaral, Dinger ME, Mercer TR, Mehler MF: ARN
regulación de procesos epigenéticos. Bioessays 2009, 31: 51-59.
2. Feng J, Fouse S, Fan G: regulación epigenética del gen neuronal
expresión y función neuronal. Pediatr Res 2007, 61: 58R63R.
3. Razin A: metilación CpG, estructura de la cromatina y gen
silenciamiento: una conexión de tres vías. EMBO J 1998, 17: 4905-4908.
4. Fukuda S, Taga T: Determinación del destino de la célula regulada por un
red de señal transcripcional en el cerebro de ratón en desarrollo.
Anat Sci Int 2005, 80: 12-18.
5. Fan G, Hutnick L: proteínas de unión a metil-CpG en el nervioso
sistema. Cell Res 2005, 15: 255-261.
6. Strathdee G, Brown R: metilación del ADN aberrante en el cáncer:
intervenciones clínicas potenciales. Experto Rev Mol Med 2002,
2002: 1-17.
7. Mueller BR, Bale TL: Programación de descendencia sexual específica
Emocionalidad después del estrés temprano en el embarazo. J Neurosci 2008,
28: 9055-9065.
Estudio de roedores que ilustra las alteraciones en la metilación del ADN de placenta y
tejido cerebral después de la exposición al estrés gestacional, proporcionando un posible
mecanismo que media los efectos neurobiológicos a largo plazo del embarazo
exposición a actividad HPA materna elevada
8. Hoet JJ, Hanson MA: nutrición intrauterina: su importancia
durante periodos críticos para enfermedades cardiovasculares y endocrinas
desarrollo. J Physiol 1999, 514 (Pt 3): 617-627.
9. Zeisel SH: Importancia de los donantes de metilo durante la reproducción.
Am J Clin Nutr 2009, 89: 673S-677S.
10. Lillycrop KA, Phillips ES, Torrens C, Hanson MA, Jackson AA,
Burdge GC: Alimentar a las ratas embarazadas con una dieta restringida en proteínas
altera de forma persistente la metilación de citosinas específicas en el
promotor hepático PPAR alfa de la descendencia. Br J Nutr 2008,
100: 278-282.
11. Lillycrop KA, Slater-Jefferies JL, Hanson MA, Godfrey KM,
Jackson AA, Burdge GC: inducción de alteración epigenética
regulación del receptor de glucocorticoides hepáticos en el
hijos de ratas alimentadas con una dieta restringida en proteínas durante el embarazo
sugiere que la expresión reducida de ADN metiltransferasa-1 es
involucrado en la alteración de la metilación del ADN y cambios en la histona
modificaciones. Br J Nutr 2007, 97: 1064-1073.
Ilustra el impacto de los donantes de metilo en la dieta materna en la descendencia
La metilación del ADN y los patrones de acetilación de histonas, proporcionando un importante
vínculo entre la nutrición y la regulación de genes
12. Vicepresidente de Kovacheva, Mellott TJ, Davison JM, Wagner N, LopezCoviella
Yo, Schnitzler AC, Blusztajn JK: Colina gestacional
la deficiencia provoca el ADN del gen global e Igf2
hipermetilación por regulación positiva de la expresión de Dnmt1. J Biol
Chem 2007, 282: 31777-31788.
13. Meaney MJ: cuidado materno, expresión genética y
transmisión de diferencias individuales en la reactividad al estrés
a través de las generaciones. Annu Rev Neurosci 2001, 24: 1161-1192.
14. Champagne FA, Weaver IC, Diorio J, Dymov S, Szyf M,
Meaney MJ: atención materna asociada con la metilación del
receptor de estrógeno-alpha1b promotor y receptores de estrógenos
expresión en el área preóptica medial de la mujer
descendencia. Endocrinología 2006, 147: 2909-2915.
15. Weaver IC, Cervoni N, Champagne FA, D'Alessio AC, Sharma S,
Seckl JR, Dymov S, Szyf M, Meaney MJ: Programación epigenética
por comportamiento maternal. Nat Neurosci 2004, 7: 847-854.
16. Weaver IC, D'Alessio AC, Brown SE, Hellstrom IC, Dymov S,
Sharma S, Szyf M, Meaney MJ: el factor de transcripción nervio
proteína inducible por factor de crecimiento a media epigenética
Programación: alteración de las marcas epigenéticas inmediatas
genes. J Neurosci 2007, 27: 1756-1768.
17. Oberlander TF, Weinberg J, Papsdorf M, Grunau R, Misri S,
Devlin AM: exposición prenatal a la depresión materna,
Metilación neonatal del gen del receptor de glucocorticoides humanos
(NR3C1) y respuestas de estrés cortisol infantil. Epigenética
2008, 3: 97-106.
Proporciona evidencia de la relevancia de los mecanismos epigenéticos en la mediación
los efectos del estado de ánimo materno en el desarrollo infantil. Ilustra el
traducción de enfoques experimentales realizados en modelos animales para
el estudio de problemas clínicamente relevantes en humanos
18. McGowan PO, Sasaki A, D'Alessio AC, Dymov S, Labonte B,
Szyf M, Turecki G, Meaney MJ: regulación epigenética de la
receptor de glucocorticoides en el cerebro humano se asocia con
abuso infantil Nat Neurosci 2009, 12: 342-348.
Proporciona pruebas convincentes de la presencia de metilación diferencial
de GR con consecuencias para la expresión de genes en el hipocampo humano
como una función del abuso en la primera infancia usando tejido cerebral obtenido
de víctimas de suicidio
19. Roth TL, Lubin FD, Funk AJ, Sweatt JD: Epigenética duradera
influencia de la adversidad de la vida temprana en el gen BDNF. Biol
Psiquiatría 2009, 65: 760-769.
Estudio de roedores sobre el impacto transgeneracional de la exposición a la
abuso en la infancia y el papel de la metilación diferencial de BDNF en el
córtex prefrontal en la mediación de estos efectos
20. Champagne FA: Mecanismos epigenéticos y
efectos transgeneracionales de la atención materna. Frente
Neuroendocrinol 2008, 29: 386-397.
21. Bruel-Jungerman E, Laroche S, Rampon C: Nuevas neuronas en el
giro dentado están involucrados en la expresión de mejora
memoria a largo plazo después del enriquecimiento ambiental.
Eur J Neurosci 2005, 21: 513-521.
22. Champagne DL, Bagot RC, van Hasselt F, Ramakers G,
Meaney MJ, de Kloet ER, Joels M, Krugers H: cuidado materno y
plasticidad hipocampal: evidencia de dependencia de la experiencia
plasticidad estructural, funcionamiento sináptico alterado y
capacidad de respuesta diferencial a los glucocorticoides y el estrés.
J Neurosci 2008, 28: 6037-6045.
23. Arai JA, Li S, Hartley DM, Feig LA: rescate transgeneracional de un
defecto genético en la potenciación y la memoria a largo plazo
formación por enriquecimiento juvenil. J Neurosci 2009, 29: 1496-
1502.
Estudio de roedores que ilustra el impacto transgeneracional del medio ambiente
enriquecimiento en LTP sugiriendo que los déficits genéticamente inducidos pueden ser
superar a través de las condiciones ambientales experimentadas por un anterior
generación de AHSS
24. Fischer A, Sananbenesi F, Wang X, Dobbin M, Tsai LH: recuperación
de aprendizaje y memoria se asocia con la cromatina
remodelación. Nature 2007, 447: 178-182.
Estudio de roedores que muestra que el enriquecimiento ambiental aumenta la histona
acetilación en el hipocampo. Los inhibidores de HDAC inducen un aumento espacial
memoria en un modelo de ratón con trastorno neurodegenerativo
25. Williams BM, Luo Y, Ward C, Redd K, Gibson R, Kuczaj SA,
McCoy JG: Enriquecimiento ambiental: efectos en el espacio
memoria e inmunorreactividad CREB hipocampal. Physiol
Behav 2001, 73: 649-658.
26. Sweatt JD: modificaciones epigenéticas dependientes de la experiencia en
el sistema nervioso central. Biol Psychiatry 2009, 65: 191-197.
27. Lubin FD, Roth TL, Sweatt JD: regulación epigenética del BDNF
transcripción de genes en la consolidación de la memoria del miedo.
J Neurosci 2008, 28: 10576-10586.
Documento reciente de una serie de investigaciones del laboratorio Sweatt que ilustra
los cambios dinámicos a la metilación del ADN que ocurren durante el proceso
de aprendizaje y el papel fundamental de estas modificaciones en la consolidación
de memoria
28. Levenson JM, Roth TL, Lubin FD, Miller CA, Huang IC, Desai P,
Malone LM, Sweatt JD: evidencia de que el ADN (citosina-5)
metiltransferasa regula la plasticidad sináptica en el
hipocampo. J Biol Chem 2006, 281: 15763-15773.
29. Guan JS, Haggarty SJ, Giacometti E, Dannenberg JH, Joseph N,
Gao J, Nieland TJ, Zhou Y, Wang X, Mazitschek R y col .: HDAC2
regula negativamente la formación de memoria y sináptica
plasticidad. Nature 2009, 459: 55-60.
Estudio en ratones que examinan el objetivo HDAC particular a través del cual HDAC
los inhibidores ejercen mejoras en la plasticidad y memoria sináptica. Utilizando
dirigida hacia arriba y hacia abajo la regulación de HDAC2 los autores ilustran el
importancia de los niveles de esta enzima en la mediación de mejora cognitiva
30. Nelson ED, Kavalali ET, Monteggia LM: dependiente de la actividad
supresión de la neurotransmisión en miniatura a través del
regulación de la metilación del ADN. J Neurosci 2008, 28: 395-406.
Este documento se centra en la regulación de la metilación del ADN por NMDA
actividad sináptica mediada por receptor dentro de las neuronas maduras y cómo
las alteraciones epigenéticas afectan la función sináptica basal. Estos hallazgos
sugieren una base sináptica para los síntomas neurológicos asociados con
trastornos del neurodesarrollo como el síndrome de Rett
31. Chen WG, Chang Q, Lin Y, Meissner A, West AE, Griffith EC,
Jaenisch R, Greenberg ME: Desrepresión de la transcripción de BDNF
implica la fosforilación dependiente de calcio de MeCP2.
Science 2003, 302: 885-889.
32. Zhou Z, Hong EJ, Cohen S, Zhao WN, Ho HY, Schmidt L,
Chen WG, Lin Y, Savner E, Griffith EC y otros .: Brain-specific
La fosforilación de MeCP2 regula el Bdnf dependiente de la actividad
transcripción, crecimiento dendrítico y maduración de la columna vertebral. Neurona
2006, 52: 255-269.
33. Moretti P, Zoghbi HY: disfunción MeCP2 en el síndrome de Rett y
trastornos relacionados. Curr Opin Genet Dev 2006, 16: 276-281.
34. Adachi M, Autry AE, Covington HE 3rd, Monteggia LM: MeCP2-
represión mediada de la transcripción en la amígdala basolateral
puede subyacer a la ansiedad aumentada en un modelo de ratón de Rett
síndrome. J Neurosci 2009, 29: 4218-4227.
35. Tropea D, Van Wart A, Sur M: mecanismos moleculares de
plasticidad dependiente de la experiencia en la corteza visual. Philos Trans
R Soc Lond B Biol Sci 2009, 364: 341-355.
36. Medini P, Pizzorusso T: experiencia visual y plasticidad del
corteza visual: un papel para los mecanismos epigenéticos. Frente Biosci
2008, 13: 3000-3007.
37. Putignano E, Lonetti G, Cancedda L, Ratto G, Costa M, Maffei L,
Pizzorusso T: downregulation de desarrollo de histona
modificaciones postraduccionales regulan la cortical visual
plasticidad. Neuron 2007, 53: 747-759.
Los autores identifican la regulación dependiente de ERK / MAPK de las modificaciones de histonas
como un nuevo mecanismo subyacente a la expresión de ocular
plasticidad de dominancia
38. Hensch TK: Mecanismos del período crítico en el desarrollo visual
corteza. Curr Top Dev Biol 2005, 69: 215-237.
39. Quarles RH: envolturas de mielina: glicoproteínas involucradas en su
formación, mantenimiento y degeneración. Cell Mol Life Sci
2002, 59: 1851-1871.
40. McGee AW, Yang Y, Fischer QS, Daw NW, Strittmatter SM:
Plasticidad basada en la experiencia de la corteza visual limitada por mielina
y el receptor Nogo. Science 2005, 309: 2222-2226.
41. Él Y, Dupree J, Wang J, Sandoval J, Li J, Liu H, Shi Y, Nave KA,
Casaccia-Bonnefil P: el factor de transcripción Yin Yang 1 es
esencial para la diferenciación de progenitores oligodendrocitos.
Neuron 2007, 55: 217-230.
42. Shen S, Casaccia-Bonnefil P: modificaciones postraduccionales
de histonas nucleosomales en linaje de oligodendrocitos
células en desarrollo y enfermedad. J Mol Neurosci 2008,
35: 13-22.
43. Shen S, Li J, Casaccia-Bonnefil P: modificaciones de histonas
afectar el tiempo de diferenciación de progenitores oligodendrocitos
en el cerebro de rata en desarrollo. J Cell Biol 2005, 169:
577-589.
44. Shen S, Sandoval J, suizo VA, Li J, Dupree J, Franklin RJ,
Casaccia-Bonnefil P: control epigenético dependiente de la edad de
los inhibidores de la diferenciación son críticos para la eficacia de la remielinización.
Nat Neurosci 2008, 11: 1024-1034.
Este documento proporciona una visión mecanicista de cómo los precursores de oligodendrocitos
la diferenciación celular está regulada epigenéticamente durante la remielinización
y cómo estos mecanismos cambian con el envejecimiento.
45. Fass DM, Butler JE, Goodman RH: la actividad deacetilasa es
requerido para la activación de cAMP de un subconjunto del objetivo CREB
genes. J Biol Chem 2003, 278: 43014-43019.
46. Vecsey CG, Hawk JD, Lattal KM, Stein JM, Fabian SA, Attner MA,
Cabrera SM, McDonough CB, Brindle PK, Abel T y otros .: Histone
inhibidores de la desacetilasa mejoran la memoria y la sináptica
plasticidad a través de CREB: activación transcripcional dependiente de CBP.
J Neurosci 2007, 27: 6128-6140.
47. Weaver IC, Meaney MJ, Szyf M: efectos de cuidado materno en el
comportamientos mediados por el transcriptoma del hipocampo y la ansiedad
en los descendientes que son reversibles en la edad adulta. Proc Natl Acad
Sci USA 2006, 103: 3480-3485.
Publicar descargos de responsabilidad
Alcance de la práctica profesional *
La información aquí contenida en "Influencias epigenéticas en el desarrollo del cerebro y la plasticidad" no pretende reemplazar una relación personal con un profesional de la salud calificado o un médico con licencia y no es un consejo médico. Lo alentamos a que tome decisiones de atención médica basadas en su investigación y asociación con un profesional de la salud calificado.
Información del blog y debates sobre el alcance
Nuestro alcance informativo se limita a la quiropráctica, musculoesquelética, medicina física, bienestar, contribuyendo etiológico alteraciones viscerosomáticas dentro de las presentaciones clínicas, la dinámica clínica del reflejo somatovisceral asociado, los complejos de subluxación, los problemas de salud delicados y/o los artículos, temas y debates de medicina funcional.
Brindamos y presentamos colaboración clínica con especialistas de diversas disciplinas. Cada especialista se rige por su ámbito de práctica profesional y su jurisdicción de licencia. Utilizamos protocolos funcionales de salud y bienestar para tratar y apoyar la atención de lesiones o trastornos del sistema musculoesquelético.
Nuestros videos, publicaciones, temas, asuntos e ideas cubren cuestiones clínicas, problemas y temas que se relacionan y respaldan directa o indirectamente nuestro ámbito de práctica clínica.*
Nuestra oficina ha intentado razonablemente proporcionar citas de apoyo y ha identificado el estudio o los estudios de investigación relevantes que respaldan nuestras publicaciones. Proporcionamos copias de los estudios de investigación de respaldo disponibles para las juntas reguladoras y el público a pedido.
Entendemos que cubrimos asuntos que requieren una explicación adicional de cómo puede ayudar en un plan de atención o protocolo de tratamiento en particular; por lo tanto, para discutir más a fondo el tema anterior, no dude en preguntar Dr. Alex Jiménez, DC, o póngase en contacto con nosotros en 915-850-0900.
Estamos aquí para ayudarlo a usted y a su familia.
Bendiciones
El Dr. Alex Jimenez corriente continua MSACP, enfermero*, CCCT, IFMCP*, CIFM*, ATN*
email: coach@elpasomedicinafuncional.com
Licenciado como Doctor en Quiropráctica (DC) en Texas & New Mexico*
Número de licencia de Texas DC TX5807, Nuevo México DC Número de licencia NM-DC2182
Licenciada como Enfermera Registrada (RN*) en Florida
Licencia de Florida N.° de licencia de RN RN9617241 (Control No. 3558029)
Estado compacto: Licencia multiestatal: Autorizado para ejercer en 40 Estados*
Matriculado actualmente: ICHS: MSN* FNP (Programa de enfermera practicante familiar)
Dr. Alex Jiménez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Mi tarjeta de presentación digital






 De nuevo te doy la bienvenida.
De nuevo te doy la bienvenida.
Los comentarios están cerrados.