Resumen Epigenético:
La mayor prevalencia de la obesidad y las comorbilidades relacionadas es un importante problema de salud pública. Si bien los factores genéticos, sin duda, juegan un papel en la determinación de la susceptibilidad individual al aumento de peso y la obesidad, las variantes genéticas identificadas solo explican parte de la variación. Esto ha llevado a un creciente interés en comprender el papel potencial de la epigenética como un mediador de las interacciones genético-ambientales que subyacen en el desarrollo de la obesidad y sus comorbilidades asociadas. La evidencia inicial en apoyo del papel de la epigenética en la obesidad y la diabetes mellitus tipo 2 (T2DM) fue proporcionada principalmente por estudios en animales, que informaron cambios epigenéticos en tejidos clave metabólicamente importantes después de la alimentación con alto contenido de grasa y diferencias epigenéticas entre animales delgados y obesos y por estudios en humanos que mostraron cambios epigenéticos en la obesidad y genes candidatos T2DM en individuos obesos / diabéticos. Más recientemente, los avances en las metodologías epigenéticas y el costo reducido de los estudios de asociación en todo el epigenoma (EWAS) han llevado a una rápida expansión de los estudios en poblaciones humanas. Estos estudios también han informado diferencias epigenéticas entre adultos obesos / T2DM y controles sanos y cambios epigenéticos en asociación con intervenciones nutricionales, de pérdida de peso y ejercicios. También hay cada vez más pruebas, tanto de estudios en humanos como en animales, de que la relación entre la exposición nutricional perinatal y el riesgo posterior de obesidad y T2DM puede estar mediada por cambios epigenéticos en la descendencia. El objetivo de esta revisión es resumir los desarrollos más recientes en este campo en rápido movimiento, con un enfoque particular en EWAS humanos y estudios que investigan el impacto de factores nutricionales y de estilo de vida (pre y postnatal) en el epigenoma y su relación con el metabolismo los resultados de salud. También se abordan las dificultades para distinguir las consecuencias de la causalidad en estos estudios y el papel crítico de los modelos animales para probar las relaciones causales y proporcionar información sobre los mecanismos subyacentes. En resumen, el área de epigenética y salud metabólica ha experimentado rápidos desarrollos en un corto espacio de tiempo. Si bien los resultados hasta la fecha son prometedores, los estudios están en curso, y la próxima década promete ser un momento de investigación productiva sobre las interacciones complejas entre el genoma, el epigenoma y el medio ambiente, ya que se relacionan con la enfermedad metabólica.
Palabras clave: Epigenética, Metilación del ADN, Obesidad, Diabetes tipo 2, Programación del desarrollo
Introducción
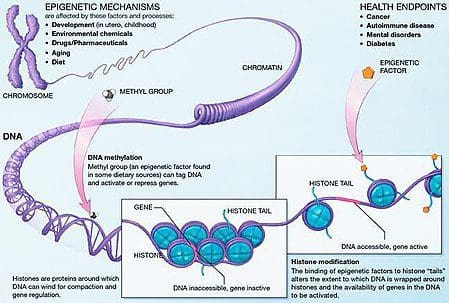 La obesidad es una enfermedad compleja y multifactorial, y una mejor comprensión de los mecanismos subyacentes a las interacciones entre el estilo de vida, el medio ambiente y la genética es fundamental para desarrollar estrategias efectivas para la prevención y el tratamiento [1].
La obesidad es una enfermedad compleja y multifactorial, y una mejor comprensión de los mecanismos subyacentes a las interacciones entre el estilo de vida, el medio ambiente y la genética es fundamental para desarrollar estrategias efectivas para la prevención y el tratamiento [1].
En una sociedad donde abundan los alimentos ricos en energía y la necesidad de actividad física es baja, existe una amplia variación en la susceptibilidad de los individuos a desarrollar obesidad y problemas metabólicos de salud. Las estimaciones del papel de la herencia en esta variación oscilan entre el 40 y el 70 %, y aunque los grandes estudios de asociación del genoma completo (GWAS) han identificado una serie de loci genéticos asociados con el riesgo de obesidad, las ~100 variantes genéticas más comunes solo representan un pequeño porcentaje de la variación en la obesidad [2, 3]. Las estimaciones de todo el genoma son más altas y representan ~20 % de la variación [3]; sin embargo, una gran parte de la heredabilidad permanece sin explicación.
Recientemente, la atención se ha centrado en investigar el papel de los cambios epigenéticos en la etiología de la obesidad. Se ha argumentado que el epigenoma puede representar el vínculo mecánico entre las variantes genéticas y los factores ambientales para determinar el riesgo de obesidad y podría ayudar a explicar la "heredabilidad faltante". Los primeros estudios epigenéticos humanos fueron pequeños y solo investigaron un número limitado de loci. Si bien esto generalmente resultó en una mala reproducibilidad, algunos de estos primeros hallazgos, por ejemplo, la relación entre la metilación de PGC1A y la diabetes mellitus tipo 2 (T2DM) [4] y otros, como se analiza en van Dijk et al. [5], se han replicado en estudios posteriores. Los avances recientes y la mayor asequibilidad de las tecnologías de alto rendimiento ahora permiten estudios de asociación amplia del epigenoma (EWAS) a gran escala y la integración de diferentes capas de información genómica para explorar las interacciones complejas entre el genotipo, el epigenoma, el transcriptoma y el medio ambiente [6†“9]. Estos estudios aún están en sus inicios, pero los resultados hasta ahora han demostrado ser prometedores para ayudar a explicar la variación en la susceptibilidad a la obesidad.
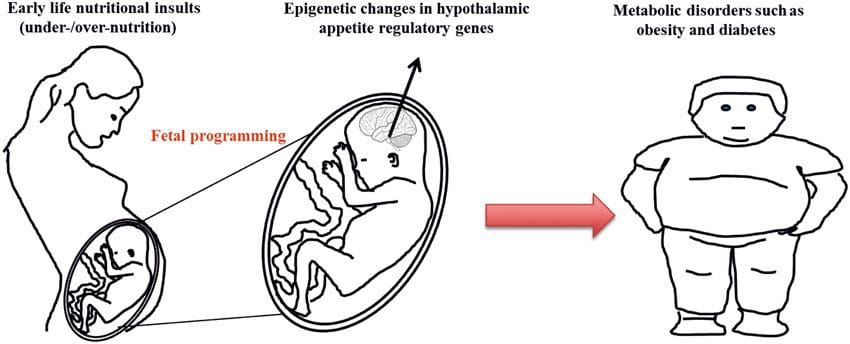
Cada vez hay más pruebas de que la obesidad tiene un origen mental, ya que la exposición a un suministro de nutrientes subóptimo antes del nacimiento o en la primera infancia se asocia con un mayor riesgo de obesidad y enfermedades metabólicas en etapas posteriores de la vida [10-13]. Inicialmente, los estudios en animales demostraron que una variedad de exposiciones nutricionales tempranas, especialmente aquellas experimentadas al principio de la gestación, podrían inducir cambios epigenéticos en tejidos metabólicos clave de la descendencia que persistieron después del nacimiento y provocaron alteraciones permanentes en la función genética [13-17] . Está surgiendo evidencia para apoyar la existencia del mismo mecanismo en humanos. Esto ha llevado a la búsqueda de marcas epigenéticas presentes en etapas tempranas de la vida que predicen el riesgo posterior de enfermedad metabólica, y a estudios para determinar si la programación epigenética de la enfermedad metabólica podría prevenirse o revertirse en la edad adulta.
Esta revisión proporciona una actualización de nuestra revisión sistemática previa de estudios sobre epigenética y obesidad en humanos [5]. Nuestra revisión previa mostró los resultados prometedores de los estudios iniciales, incluidas las primeras marcas epigenéticas potenciales para la obesidad que podrían detectarse al nacer (p. Ej., RXRA) [18]. Sin embargo, también destacó la reproducibilidad limitada de los hallazgos y la falta de investigaciones longitudinales a gran escala. La revisión actual se centra en los desarrollos recientes en este campo rápidamente cambiante y, en particular, en EWAS humanos y estudios que investigan el impacto de factores nutricionales y de estilo de vida (pre y postnatales) en el epigenoma y el papel emergente de la epigenética en la patología de la obesidad . También abordamos las dificultades para identificar la causalidad en estos estudios y la importancia de los modelos animales para proporcionar información sobre los mecanismos.
Revisar
Cambios epigenéticos en modelos animales de obesidad
 Los modelos animales brindan oportunidades únicas para estudios altamente controlados que brindan información mecánica sobre el papel de marcas epigenéticas específicas, tanto como indicadores del estado metabólico actual como predictores del riesgo futuro de obesidad y enfermedades metabólicas. Un aspecto particularmente importante de los estudios en animales es que permiten la evaluación de los cambios epigenéticos dentro de los tejidos diana, incluidos el hígado y el hipotálamo, lo que es mucho más difícil en los seres humanos. Además, la capacidad de recolectar grandes cantidades de tejido fresco permite evaluar múltiples marcas de cromatina, así como la metilación del ADN. Algunas de estas modificaciones epigenéticas, solas o en combinación, pueden responder a la programación ambiental. En modelos animales, también es posible estudiar múltiples generaciones de descendencia y, por lo tanto, permitir la diferenciación entre la transmisión transgeneracional e intergeneracional del riesgo de obesidad mediado por la memoria epigenética del estado nutricional de los padres, que no se puede distinguir fácilmente en estudios humanos. Usamos el primer término para la transmisión meiótica del riesgo en ausencia de una exposición continua, mientras que el segundo implica principalmente la transmisión directa del riesgo a través de la reprogramación metabólica del feto o los gametos.
Los modelos animales brindan oportunidades únicas para estudios altamente controlados que brindan información mecánica sobre el papel de marcas epigenéticas específicas, tanto como indicadores del estado metabólico actual como predictores del riesgo futuro de obesidad y enfermedades metabólicas. Un aspecto particularmente importante de los estudios en animales es que permiten la evaluación de los cambios epigenéticos dentro de los tejidos diana, incluidos el hígado y el hipotálamo, lo que es mucho más difícil en los seres humanos. Además, la capacidad de recolectar grandes cantidades de tejido fresco permite evaluar múltiples marcas de cromatina, así como la metilación del ADN. Algunas de estas modificaciones epigenéticas, solas o en combinación, pueden responder a la programación ambiental. En modelos animales, también es posible estudiar múltiples generaciones de descendencia y, por lo tanto, permitir la diferenciación entre la transmisión transgeneracional e intergeneracional del riesgo de obesidad mediado por la memoria epigenética del estado nutricional de los padres, que no se puede distinguir fácilmente en estudios humanos. Usamos el primer término para la transmisión meiótica del riesgo en ausencia de una exposición continua, mientras que el segundo implica principalmente la transmisión directa del riesgo a través de la reprogramación metabólica del feto o los gametos.
Los estudios en animales han jugado un papel fundamental en nuestra comprensión actual del papel de la epigenética en los orígenes del desarrollo de la obesidad y la DM2. Tanto el aumento como la disminución de la nutrición materna durante el embarazo se han asociado con un aumento de la deposición de grasa en la descendencia de la mayoría de las especies de mamíferos estudiadas hasta la fecha (revisado en [11, 13–15, 19]). La nutrición materna durante el embarazo no solo tiene el potencial de efectos directos sobre el feto, sino que también puede afectar directamente a los ovocitos en desarrollo de los fetos femeninos y las células germinales primordiales de los fetos masculinos y, por lo tanto, podría afectar tanto a la descendencia como a los nietos. Por lo tanto, generalmente se requieren datos multigeneracionales para diferenciar entre los mecanismos de transmisión maternos intergeneracionales y transgeneracionales.
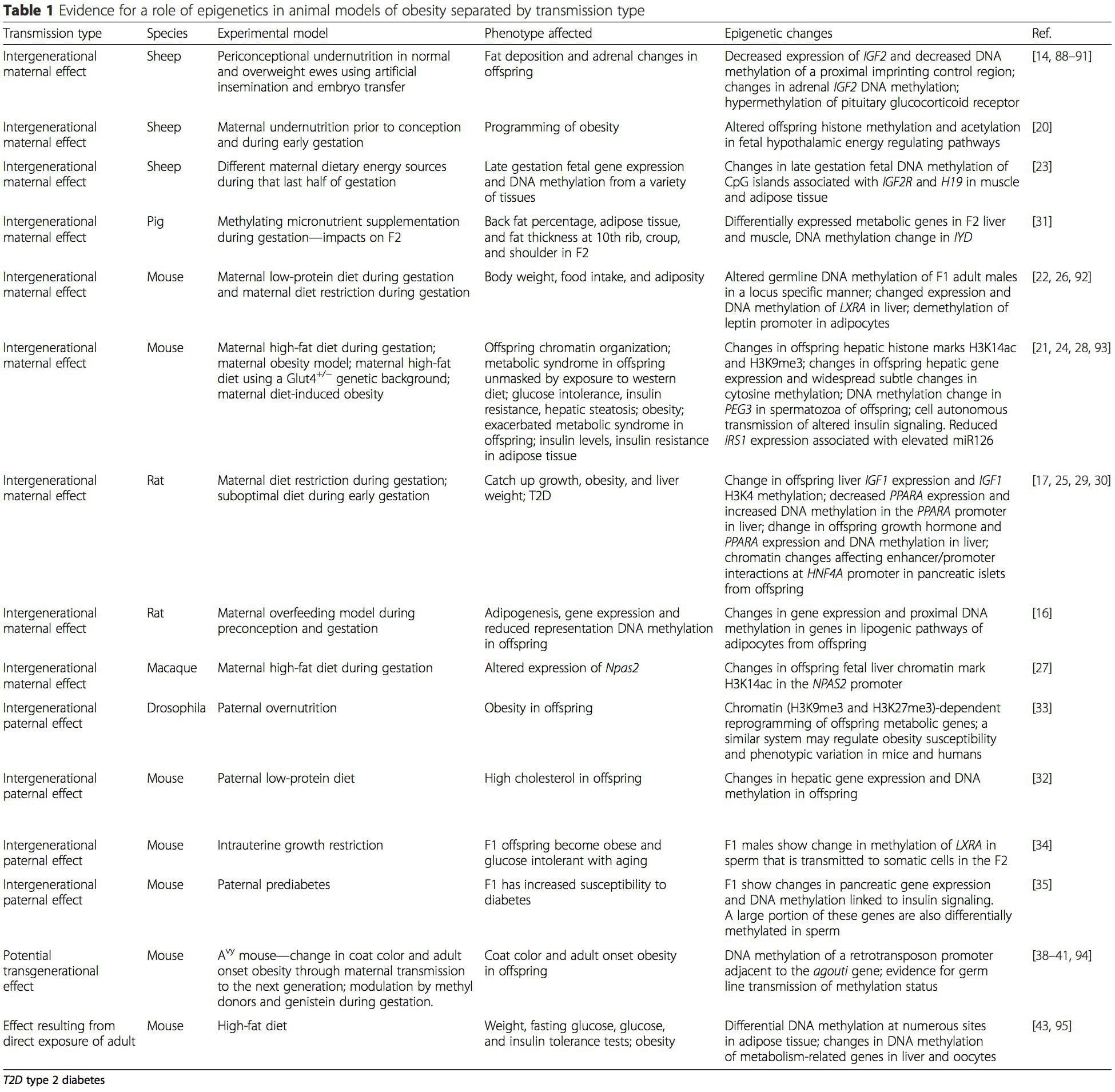
La Tabla 1 resume una variedad de modelos animales que se han utilizado para proporcionar evidencia de cambios metabólicos y epigenéticos en la descendencia asociada con el plano parental de nutrición. También contiene información relacionada con estudios que identifican marcas epigenéticas alteradas en individuos adultos que se someten a desafíos nutricionales directos. La tabla está estructurada según el tipo de transmisión de riesgo sugerido.
 (i) Cambios epigenéticos en los descendientes asociados con la nutrición materna durante la gestación
(i) Cambios epigenéticos en los descendientes asociados con la nutrición materna durante la gestación
 La suplementación nutricional materna, la desnutrición y la sobrenutrición durante el embarazo pueden alterar la deposición de grasa y la homeostasis energética en la descendencia [11, 13–15, 19]. Asociados con estos efectos en la descendencia están los cambios en la metilación del ADN, las modificaciones postraduccionales de las histonas y la expresión génica de varios genes diana, especialmente los genes que regulan el metabolismo de los ácidos grasos y la señalización de la insulina [16, 17, 20-30]. La diversidad de modelos animales utilizados en estos estudios y las vías metabólicas comunes afectadas sugieren una respuesta adaptativa conservada evolutivamente mediada por modificación epigenética. Sin embargo, pocos de los genes específicos identificados y los cambios epigenéticos se han validado de forma cruzada en estudios relacionados y, por lo general, no se han aplicado investigaciones a gran escala en todo el genoma. Un obstáculo importante para la comparación de estos estudios son las diferentes ventanas de desarrollo sujetas al desafío nutricional, que pueden causar resultados considerablemente diferentes. También se requiere prueba de que los cambios epigenéticos son causales en lugar de estar asociados con cambios fenotípicos en la descendencia. Esto requerirá la identificación de una respuesta de "memoria" epigenética inducida por la nutrición de los padres que precede al desarrollo del fenotipo alterado en la descendencia.
La suplementación nutricional materna, la desnutrición y la sobrenutrición durante el embarazo pueden alterar la deposición de grasa y la homeostasis energética en la descendencia [11, 13–15, 19]. Asociados con estos efectos en la descendencia están los cambios en la metilación del ADN, las modificaciones postraduccionales de las histonas y la expresión génica de varios genes diana, especialmente los genes que regulan el metabolismo de los ácidos grasos y la señalización de la insulina [16, 17, 20-30]. La diversidad de modelos animales utilizados en estos estudios y las vías metabólicas comunes afectadas sugieren una respuesta adaptativa conservada evolutivamente mediada por modificación epigenética. Sin embargo, pocos de los genes específicos identificados y los cambios epigenéticos se han validado de forma cruzada en estudios relacionados y, por lo general, no se han aplicado investigaciones a gran escala en todo el genoma. Un obstáculo importante para la comparación de estos estudios son las diferentes ventanas de desarrollo sujetas al desafío nutricional, que pueden causar resultados considerablemente diferentes. También se requiere prueba de que los cambios epigenéticos son causales en lugar de estar asociados con cambios fenotípicos en la descendencia. Esto requerirá la identificación de una respuesta de "memoria" epigenética inducida por la nutrición de los padres que precede al desarrollo del fenotipo alterado en la descendencia.
(ii) Efectos de la nutrición paterna en las marcas epigenéticas de la descendencia
 Estudios emergentes han demostrado que el plano paterno de nutrición puede afectar la deposición de grasa de la descendencia y las marcas epigenéticas [31–34]. Una investigación reciente con ratones ha demostrado que la prediabetes paterna conduce a una mayor susceptibilidad a la diabetes en la descendencia F1 con cambios asociados en la expresión génica pancreática y la metilación del ADN vinculada a la señalización de la insulina [35]. Es importante destacar que hubo una superposición de estos cambios epigenéticos en los islotes pancreáticos y los espermatozoides, lo que sugiere una herencia de línea germinal. Sin embargo, la mayoría de estos estudios, aunque intrigantes en sus implicaciones, están limitados en la escala genómica de investigación y con frecuencia muestran alteraciones epigenéticas débiles y algo transitorias asociadas con fenotipos metabólicos leves en la descendencia.
Estudios emergentes han demostrado que el plano paterno de nutrición puede afectar la deposición de grasa de la descendencia y las marcas epigenéticas [31–34]. Una investigación reciente con ratones ha demostrado que la prediabetes paterna conduce a una mayor susceptibilidad a la diabetes en la descendencia F1 con cambios asociados en la expresión génica pancreática y la metilación del ADN vinculada a la señalización de la insulina [35]. Es importante destacar que hubo una superposición de estos cambios epigenéticos en los islotes pancreáticos y los espermatozoides, lo que sugiere una herencia de línea germinal. Sin embargo, la mayoría de estos estudios, aunque intrigantes en sus implicaciones, están limitados en la escala genómica de investigación y con frecuencia muestran alteraciones epigenéticas débiles y algo transitorias asociadas con fenotipos metabólicos leves en la descendencia.
(iii) Cambios epigenéticos transgeneracionales potenciales que promueven la deposición de grasa en crías
 La transmisión estable de información epigenética a través de múltiples generaciones está bien descrita en sistemas de plantas y C. elegans, pero su importancia en los mamíferos aún es muy debatida [36, 37]. Se ha establecido bien una base epigenética para la transmisión de fenotipos por parte de los abuelos en respuesta a exposiciones dietéticas, incluso en especies de ganado [31]. Los estudios más influyentes que demuestran los efectos de la transmisión epigenética que afectan el fenotipo de la descendencia han utilizado el ejemplo del ratón agutí amarillo viable (Avy) [38]. En este ratón, una inserción de un retrotransposón aguas arriba del gen agutí provoca su expresión constitutiva y el consiguiente color amarillo del pelaje y la aparición de obesidad en la edad adulta. La transmisión materna a través de la línea germinal da como resultado el silenciamiento de la expresión agutí mediada por la metilación del ADN, lo que da como resultado un color de pelaje de tipo salvaje y un fenotipo magro de la descendencia [39, 40]. Es importante destacar que estudios posteriores en estos ratones demostraron que la exposición materna a donantes de metilo provoca un cambio en el color del pelaje [41]. Un estudio informó la transmisión de un fenotipo a la generación F3 y alteraciones en la expresión de un gran número de genes en respuesta a la restricción de proteínas en F0 [42]; sin embargo, las alteraciones en la expresión fueron muy variables y no se identificó un vínculo directo con los cambios epigenéticos en este sistema.
La transmisión estable de información epigenética a través de múltiples generaciones está bien descrita en sistemas de plantas y C. elegans, pero su importancia en los mamíferos aún es muy debatida [36, 37]. Se ha establecido bien una base epigenética para la transmisión de fenotipos por parte de los abuelos en respuesta a exposiciones dietéticas, incluso en especies de ganado [31]. Los estudios más influyentes que demuestran los efectos de la transmisión epigenética que afectan el fenotipo de la descendencia han utilizado el ejemplo del ratón agutí amarillo viable (Avy) [38]. En este ratón, una inserción de un retrotransposón aguas arriba del gen agutí provoca su expresión constitutiva y el consiguiente color amarillo del pelaje y la aparición de obesidad en la edad adulta. La transmisión materna a través de la línea germinal da como resultado el silenciamiento de la expresión agutí mediada por la metilación del ADN, lo que da como resultado un color de pelaje de tipo salvaje y un fenotipo magro de la descendencia [39, 40]. Es importante destacar que estudios posteriores en estos ratones demostraron que la exposición materna a donantes de metilo provoca un cambio en el color del pelaje [41]. Un estudio informó la transmisión de un fenotipo a la generación F3 y alteraciones en la expresión de un gran número de genes en respuesta a la restricción de proteínas en F0 [42]; sin embargo, las alteraciones en la expresión fueron muy variables y no se identificó un vínculo directo con los cambios epigenéticos en este sistema.
(iv) Exposición directa de individuos al exceso de nutrición en la vida postnatal
 Si bien muchos estudios han identificado cambios epigenéticos asociados a la dieta en modelos animales que usan regiones candidatas específicas del sitio, se han llevado a cabo pocos análisis de todo el genoma. Un estudio reciente se centró en determinar el impacto epigenético directo de las dietas altas en grasas / obesidad inducida por la dieta en ratones adultos utilizando la expresión génica de todo el genoma y los análisis de metilación del ADN [43]. Este estudio identificó regiones 232 diferencialmente metiladas (DMR) en adipocitos de ratones control y alimentados con alto contenido de grasa. Es importante destacar que las regiones humanas correspondientes para los DMR murinos también se metilaron diferencialmente en el tejido adiposo de una población de humanos obesos y delgados, lo que pone de relieve la notable conservación evolutiva de estas regiones. Este resultado enfatiza la posible importancia de los DMR identificados en la regulación de la homeostasis energética en mamíferos.
Si bien muchos estudios han identificado cambios epigenéticos asociados a la dieta en modelos animales que usan regiones candidatas específicas del sitio, se han llevado a cabo pocos análisis de todo el genoma. Un estudio reciente se centró en determinar el impacto epigenético directo de las dietas altas en grasas / obesidad inducida por la dieta en ratones adultos utilizando la expresión génica de todo el genoma y los análisis de metilación del ADN [43]. Este estudio identificó regiones 232 diferencialmente metiladas (DMR) en adipocitos de ratones control y alimentados con alto contenido de grasa. Es importante destacar que las regiones humanas correspondientes para los DMR murinos también se metilaron diferencialmente en el tejido adiposo de una población de humanos obesos y delgados, lo que pone de relieve la notable conservación evolutiva de estas regiones. Este resultado enfatiza la posible importancia de los DMR identificados en la regulación de la homeostasis energética en mamíferos.
Estudios Humanos
Basándose en la evidencia de los estudios en animales y con la disponibilidad cada vez mayor de herramientas asequibles para el análisis genómico, se ha producido una rápida expansión de los estudios de epigenoma en humanos. Estos estudios se han centrado principalmente en la identificación de diferencias específicas de sitio en la metilación del ADN que están asociadas con fenotipos metabólicos.
Una cuestión clave es la medida en que las modificaciones epigenéticas contribuyen al desarrollo del fenotipo metabólico, en lugar de simplemente ser una consecuencia de ello (Fig. 1). La programación epigenética podría contribuir al desarrollo de la obesidad y desempeñar un papel en el riesgo consiguiente de problemas cardiovasculares y metabólicos. En estudios en humanos, es difícil demostrar la causalidad [44], pero se pueden hacer inferencias a partir de varias líneas de evidencia:
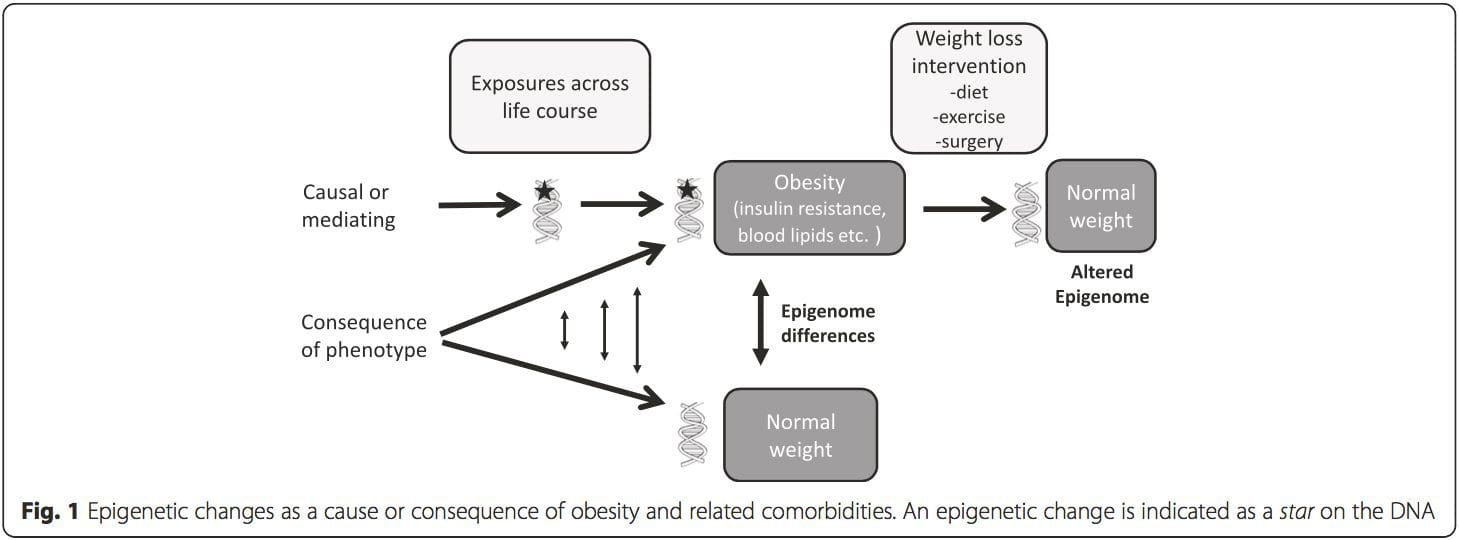 (i) Estudios de asociación genética. Los polimorfismos genéticos que están asociados con un mayor riesgo de desarrollar condiciones particulares están vinculados a priori a los genes causantes. La presencia de metilación diferencial en tales regiones infiere la relevancia funcional de estos cambios epigenéticos en el control de la expresión de los genes proximales. Existen fuertes efectos genéticos que actúan en cis que sustentan gran parte de la variación epigenética [7, 45] y, en estudios basados en poblaciones, se han aplicado métodos que utilizan sustitutos genéticos para inferir un papel causal o mediador de las diferencias del epigenoma [7, 46–48 ]. El uso de información genética familiar también puede conducir a la identificación de regiones candidatas potencialmente causales que muestren metilación diferencial relacionada con el fenotipo [49].
(i) Estudios de asociación genética. Los polimorfismos genéticos que están asociados con un mayor riesgo de desarrollar condiciones particulares están vinculados a priori a los genes causantes. La presencia de metilación diferencial en tales regiones infiere la relevancia funcional de estos cambios epigenéticos en el control de la expresión de los genes proximales. Existen fuertes efectos genéticos que actúan en cis que sustentan gran parte de la variación epigenética [7, 45] y, en estudios basados en poblaciones, se han aplicado métodos que utilizan sustitutos genéticos para inferir un papel causal o mediador de las diferencias del epigenoma [7, 46–48 ]. El uso de información genética familiar también puede conducir a la identificación de regiones candidatas potencialmente causales que muestren metilación diferencial relacionada con el fenotipo [49].
(ii) Tiempo de cambios epigenéticos. La presencia de una marca epigenética antes del desarrollo de un fenotipo es una característica esencial asociada con la causalidad. Por el contrario, la presencia de una marca en asociación con la obesidad, pero no antes de su desarrollo, se puede utilizar para excluir la causalidad, pero no excluiría un posible papel en la patología posterior relacionada con la obesidad.
(iii) Inferencia plausible del mecanismo. Esto se refiere a cambios epigenéticos que están asociados con la expresión alterada de genes con un papel establecido en la regulación del fenotipo de interés. Un ejemplo de esto es la asociación de la metilación en dos sitios CpG en el gen CPT1A con niveles circulantes de triglicéridos [50]. CPT1A codifica la carnitina palmitoiltransferasa 1A, una enzima con un papel central en el metabolismo de los ácidos grasos, y esto es muy indicativo de que la metilación diferencial de este gen puede estar causalmente relacionada con las alteraciones en las concentraciones plasmáticas de triglicéridos.
Estudios de asociación de Epigenoma completo: identificación de biomarcadores epigenéticos de la salud metabólica
Varias investigaciones recientes se han centrado en explorar las asociaciones entre la obesidad/enfermedades metabólicas y la metilación del ADN en todo el genoma (Tabla 2). El EWAS más grande publicado hasta el momento, que incluye un total de 5465 individuos, identificó 37 sitios de metilación en la sangre que estaban asociados con el índice de masa corporal (IMC), incluidos sitios en CPT1A, ABCG1 y SREBF1 [51]. Otro estudio a gran escala mostró asociaciones consistentes entre el IMC y la metilación en HIF3A en sangre completa y tejido adiposo [52], un hallazgo que también se repitió parcialmente en otros estudios [9, 51]. Otras asociaciones informadas recientemente entre las medidas relacionadas con la obesidad y la metilación del ADN incluyen (i) diferencias en la metilación del ADN entre personas magras y delgadas. obeso individuos en LY86 en leucocitos en sangre [53]; (ii) asociaciones entre la metilación del promotor de PGC1A en sangre completa de niños y la adiposidad 5 años después [54]; (iii) asociaciones entre la relación cintura-cadera y la metilación de ADRB3 en sangre [55]; y (iv) asociaciones entre el IMC, las medidas de distribución de la grasa corporal y múltiples sitios de metilación del ADN en el tejido adiposo [9, 56]. Los EWAS también han mostrado asociaciones entre los sitios de metilación del ADN y los lípidos sanguíneos [55, 57–59], los metabolitos séricos [60], la resistencia a la insulina [9, 61] y la DM2 [48, 62, 63] (Tabla 2).
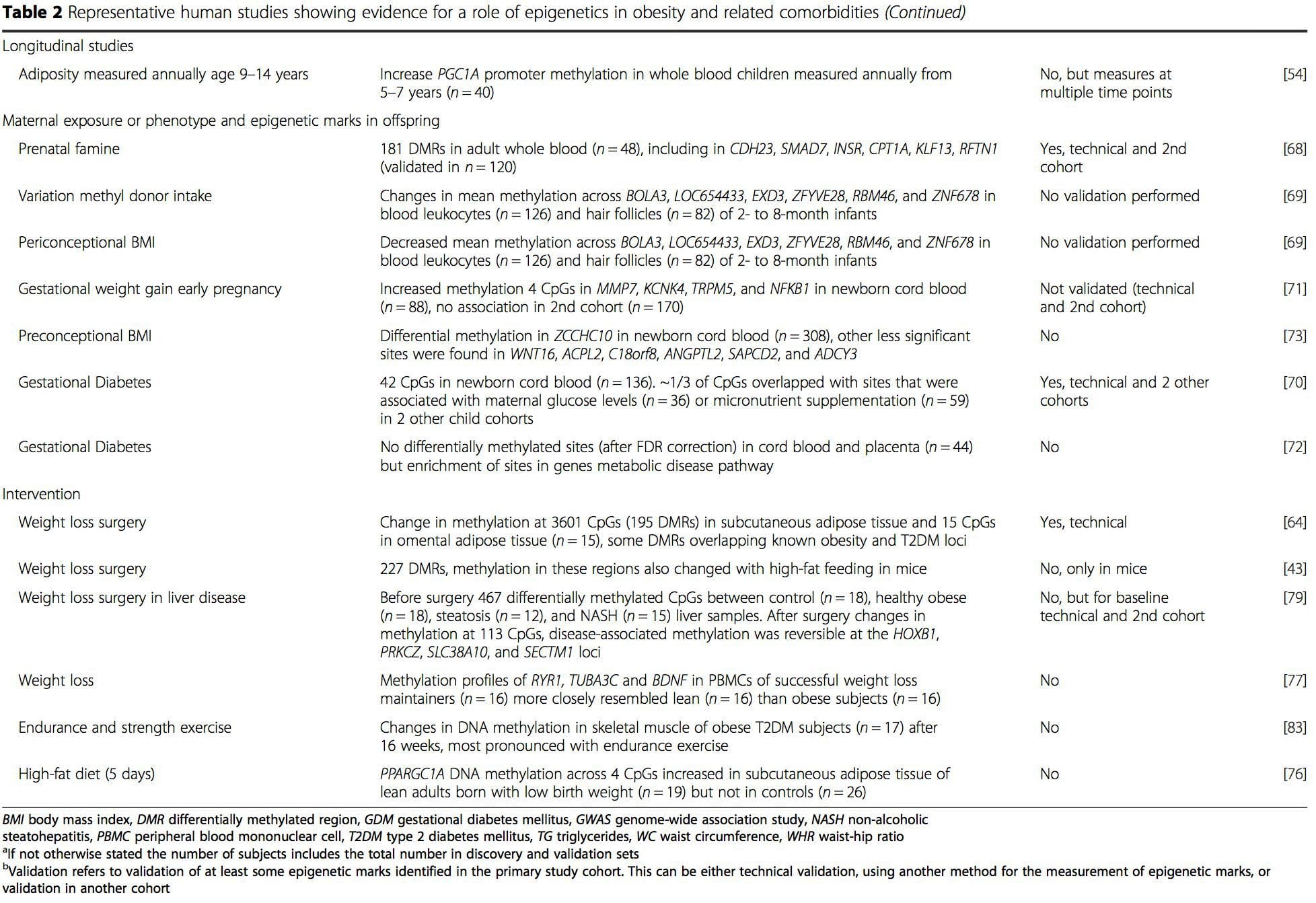 A partir de estos estudios, la metilación alterada de PGC1A, HIF3A, ABCG1 y CPT1A y la RXRA [18] descrita anteriormente se han convertido en biomarcadores asociados con, o quizás predictivos de, la salud metabólica que también son candidatos plausibles para un papel en el desarrollo de enfermedad metabólica .
A partir de estos estudios, la metilación alterada de PGC1A, HIF3A, ABCG1 y CPT1A y la RXRA [18] descrita anteriormente se han convertido en biomarcadores asociados con, o quizás predictivos de, la salud metabólica que también son candidatos plausibles para un papel en el desarrollo de enfermedad metabólica .
Interacción entre el genotipo y el epigenoma
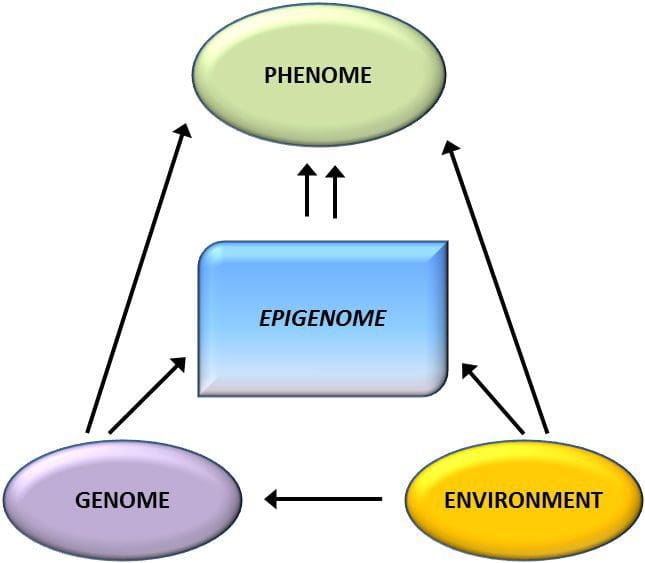 La variación epigenética está muy influenciada por la variación genética subyacente, y se estima que el genotipo explica ~20-40 % de la variación [6, 8]. Recientemente, varios estudios han comenzado a integrar datos de metilomas y genotipos para identificar loci de rasgos cuantitativos de metilación (meQTL) asociados con fenotipos de enfermedades. Por ejemplo, en el tejido adiposo, se ha identificado un meQTL superpuesto con un locus de riesgo genético del IMC en un elemento potenciador aguas arriba de ADCY3 [8]. Otros estudios también han identificado superposiciones entre la obesidad conocida y los loci de riesgo de DM2 y las DMR asociadas con la obesidad y la DM2 [43, 48, 62]. La metilación de varios de estos DMR también fue modulada por la alimentación rica en grasas en ratones [43] y la pérdida de peso en humanos [64]. Estos resultados identifican un vínculo intrigante entre las variaciones genéticas relacionadas con la susceptibilidad a la enfermedad y su asociación con regiones del genoma que sufren modificaciones epigenéticas en respuesta a desafíos nutricionales, lo que implica una relación causal. La estrecha conexión entre la variación genética y epigenética puede significar sus roles esenciales en la generación de variación individual [65, 66]. Sin embargo, si bien estos hallazgos sugieren que la metilación del ADN puede ser un mediador de los efectos genéticos, también es importante considerar que tanto los procesos genéticos como los epigenéticos podrían actuar de forma independiente sobre los mismos genes. Los estudios de gemelos [8, 63, 67] pueden proporcionar información importante e indicar que las diferencias entre individuos en los niveles de metilación del ADN surgen predominantemente del entorno no compartido y las influencias estocásticas, mínimamente de los efectos ambientales compartidos, pero también con un impacto significativo de la herencia genética. variación.
La variación epigenética está muy influenciada por la variación genética subyacente, y se estima que el genotipo explica ~20-40 % de la variación [6, 8]. Recientemente, varios estudios han comenzado a integrar datos de metilomas y genotipos para identificar loci de rasgos cuantitativos de metilación (meQTL) asociados con fenotipos de enfermedades. Por ejemplo, en el tejido adiposo, se ha identificado un meQTL superpuesto con un locus de riesgo genético del IMC en un elemento potenciador aguas arriba de ADCY3 [8]. Otros estudios también han identificado superposiciones entre la obesidad conocida y los loci de riesgo de DM2 y las DMR asociadas con la obesidad y la DM2 [43, 48, 62]. La metilación de varios de estos DMR también fue modulada por la alimentación rica en grasas en ratones [43] y la pérdida de peso en humanos [64]. Estos resultados identifican un vínculo intrigante entre las variaciones genéticas relacionadas con la susceptibilidad a la enfermedad y su asociación con regiones del genoma que sufren modificaciones epigenéticas en respuesta a desafíos nutricionales, lo que implica una relación causal. La estrecha conexión entre la variación genética y epigenética puede significar sus roles esenciales en la generación de variación individual [65, 66]. Sin embargo, si bien estos hallazgos sugieren que la metilación del ADN puede ser un mediador de los efectos genéticos, también es importante considerar que tanto los procesos genéticos como los epigenéticos podrían actuar de forma independiente sobre los mismos genes. Los estudios de gemelos [8, 63, 67] pueden proporcionar información importante e indicar que las diferencias entre individuos en los niveles de metilación del ADN surgen predominantemente del entorno no compartido y las influencias estocásticas, mínimamente de los efectos ambientales compartidos, pero también con un impacto significativo de la herencia genética. variación.
El impacto del entorno prenatal y postnatal en el Epigenoma
 Ambiente prenatal: Dos estudios publicados recientemente utilizaron poblaciones humanas que experimentaron variaciones "naturales" en el suministro de nutrientes para estudiar el impacto de la nutrición materna antes o durante el embarazo en la metilación del ADN en la descendencia [68, 69]. El primer estudio utilizó una cohorte de madre e hijo de Gambia para mostrar que tanto las variaciones estacionales en la ingesta materna de donantes de metilo durante el embarazo como el IMC materno antes del embarazo estaban asociados con una metilación alterada en los bebés [69]. El segundo estudio utilizó crías adultas de la cohorte Dutch Hunger Winter para investigar el efecto de la exposición prenatal a un período agudo de desnutrición materna severa en la metilación del ADN de los genes implicados en el crecimiento y el metabolismo en la edad adulta [68]. Los resultados destacaron la importancia del momento de la exposición en su impacto en el epigenoma, ya que solo se identificaron efectos epigenéticos significativos en individuos expuestos a la hambruna durante la gestación temprana. Es importante destacar que los cambios epigenéticos ocurrieron junto con un mayor IMC; sin embargo, no fue posible establecer en este estudio si estos cambios estaban presentes antes en la vida o eran consecuencia del mayor IMC.
Ambiente prenatal: Dos estudios publicados recientemente utilizaron poblaciones humanas que experimentaron variaciones "naturales" en el suministro de nutrientes para estudiar el impacto de la nutrición materna antes o durante el embarazo en la metilación del ADN en la descendencia [68, 69]. El primer estudio utilizó una cohorte de madre e hijo de Gambia para mostrar que tanto las variaciones estacionales en la ingesta materna de donantes de metilo durante el embarazo como el IMC materno antes del embarazo estaban asociados con una metilación alterada en los bebés [69]. El segundo estudio utilizó crías adultas de la cohorte Dutch Hunger Winter para investigar el efecto de la exposición prenatal a un período agudo de desnutrición materna severa en la metilación del ADN de los genes implicados en el crecimiento y el metabolismo en la edad adulta [68]. Los resultados destacaron la importancia del momento de la exposición en su impacto en el epigenoma, ya que solo se identificaron efectos epigenéticos significativos en individuos expuestos a la hambruna durante la gestación temprana. Es importante destacar que los cambios epigenéticos ocurrieron junto con un mayor IMC; sin embargo, no fue posible establecer en este estudio si estos cambios estaban presentes antes en la vida o eran consecuencia del mayor IMC.
Otros estudios recientes han proporcionado evidencia de que la sobrenutrición prenatal y un entorno materno obeso o diabético también están asociados con cambios en la metilación del ADN en genes relacionados con el desarrollo embrionario, el crecimiento y la enfermedad metabólica en la descendencia [70-73].
Si bien los datos en humanos son escasos, hay indicios de que la obesidad paterna puede conducir a una metilación alterada de genes impresos en el recién nacido [74], un efecto que se cree que está mediado por cambios epigenéticos adquiridos durante la espermatogénesis.
 Ambiente postnatal: El epigenoma se establece de novo durante el desarrollo embrionario y, por lo tanto, es muy probable que el entorno prenatal tenga el impacto más significativo en el epigenoma. Sin embargo, ahora está claro que ocurren cambios en el epigenoma "maduro" bajo la influencia de una variedad de condiciones, que incluyen el envejecimiento, la exposición a toxinas y alteraciones en la dieta. Por ejemplo, se han demostrado cambios en la metilación del ADN en numerosos genes en el músculo esquelético y PGC1A en el tejido adiposo en respuesta a una dieta rica en grasas [75, 76]. Las intervenciones para perder masa grasa corporal también se han asociado con cambios en la metilación del ADN. Los estudios han informado que los perfiles de metilación del ADN del tejido adiposo [43, 64], las células mononucleares de sangre periférica [77] y el tejido muscular [78] en pacientes anteriormente obesos se vuelven más similares a los perfiles de sujetos delgados después de la pérdida de peso. La cirugía de pérdida de peso también revirtió parcialmente los cambios de metilación en el hígado asociados con la enfermedad del hígado graso no alcohólico [79] y en otro estudio condujo a la hipometilación de múltiples genes candidatos a la obesidad, con efectos más pronunciados en la grasa subcutánea en comparación con la grasa omental (visceral) [64] . La evidencia acumulada sugiere que las intervenciones de ejercicio también pueden influir en la metilación del ADN. La mayoría de estos estudios se han realizado en individuos delgados [80-82], pero un estudio de ejercicio en sujetos obesos con DM2 también demostró cambios en la metilación del ADN, incluidos los genes implicados en el transporte de ácidos grasos y glucosa [83]. Los cambios epigenéticos también ocurren con el envejecimiento, y datos recientes sugieren un papel de la obesidad en su aumento [9, 84, 85]. La obesidad aceleró la edad epigenética del tejido hepático, pero a diferencia de los hallazgos descritos anteriormente, este efecto no fue reversible después de la pérdida de peso [84].
Ambiente postnatal: El epigenoma se establece de novo durante el desarrollo embrionario y, por lo tanto, es muy probable que el entorno prenatal tenga el impacto más significativo en el epigenoma. Sin embargo, ahora está claro que ocurren cambios en el epigenoma "maduro" bajo la influencia de una variedad de condiciones, que incluyen el envejecimiento, la exposición a toxinas y alteraciones en la dieta. Por ejemplo, se han demostrado cambios en la metilación del ADN en numerosos genes en el músculo esquelético y PGC1A en el tejido adiposo en respuesta a una dieta rica en grasas [75, 76]. Las intervenciones para perder masa grasa corporal también se han asociado con cambios en la metilación del ADN. Los estudios han informado que los perfiles de metilación del ADN del tejido adiposo [43, 64], las células mononucleares de sangre periférica [77] y el tejido muscular [78] en pacientes anteriormente obesos se vuelven más similares a los perfiles de sujetos delgados después de la pérdida de peso. La cirugía de pérdida de peso también revirtió parcialmente los cambios de metilación en el hígado asociados con la enfermedad del hígado graso no alcohólico [79] y en otro estudio condujo a la hipometilación de múltiples genes candidatos a la obesidad, con efectos más pronunciados en la grasa subcutánea en comparación con la grasa omental (visceral) [64] . La evidencia acumulada sugiere que las intervenciones de ejercicio también pueden influir en la metilación del ADN. La mayoría de estos estudios se han realizado en individuos delgados [80-82], pero un estudio de ejercicio en sujetos obesos con DM2 también demostró cambios en la metilación del ADN, incluidos los genes implicados en el transporte de ácidos grasos y glucosa [83]. Los cambios epigenéticos también ocurren con el envejecimiento, y datos recientes sugieren un papel de la obesidad en su aumento [9, 84, 85]. La obesidad aceleró la edad epigenética del tejido hepático, pero a diferencia de los hallazgos descritos anteriormente, este efecto no fue reversible después de la pérdida de peso [84].
Colectivamente, la evidencia en apoyo de la capacidad de modular el epigenoma en adultos sugiere que puede haber la posibilidad de intervenir en la vida postnatal para modular o revertir la programación epigenética adversa.
Tamaños de efectos y diferencias entre los tipos de tejidos
![]() Los cambios en la metilación del ADN asociados con la obesidad o inducidos por intervenciones en la dieta o el estilo de vida y la pérdida de peso son generalmente modestos (<15%), aunque esto varía según el fenotipo y el tejido estudiado. Por ejemplo, se han informado cambios superiores al 20% en el tejido adiposo después de la pérdida de peso [64] y las asociaciones entre la metilación de HIF3A y el IMC en el tejido adiposo fueron más pronunciadas que en la sangre [52].
Los cambios en la metilación del ADN asociados con la obesidad o inducidos por intervenciones en la dieta o el estilo de vida y la pérdida de peso son generalmente modestos (<15%), aunque esto varía según el fenotipo y el tejido estudiado. Por ejemplo, se han informado cambios superiores al 20% en el tejido adiposo después de la pérdida de peso [64] y las asociaciones entre la metilación de HIF3A y el IMC en el tejido adiposo fueron más pronunciadas que en la sangre [52].
La relevancia biológica de los cambios de metilación relativamente pequeños ha sido cuestionada. Sin embargo, en tejidos que consisten en una mezcla de tipos celulares, un pequeño cambio en la metilación del ADN puede reflejar un cambio significativo en una fracción celular específica. La integración de datos de epigenoma con transcriptoma y otros datos epigenéticos, como modificaciones de histonas, es importante, ya que los pequeños cambios en la metilación del ADN podrían reflejar cambios más grandes en la estructura de la cromatina y podrían asociarse con cambios más amplios en la expresión génica. El contexto genómico también debe ser considerado; pequeños cambios dentro de un elemento regulador como un promotor, potenciador o aislante pueden tener un significado funcional. En este sentido, se ha observado que los DMR para la obesidad, así como las regiones afectadas por la exposición al hambre prenatal y meQTL para los loci del rasgo metabólico se superponen a los elementos potenciadores [8, 43, 68]. Existe evidencia de que la metilación del ADN en las regiones asociadas al hambre podría afectar la actividad potenciadora [68], lo que respalda el papel de los cambios de metilación inducidos por la nutrición en la regulación génica.
Una limitación importante en muchos estudios en humanos es que las marcas epigenéticas a menudo se evalúan en sangre periférica, en lugar de en tejidos metabólicamente relevantes (Fig. 2). La heterogeneidad de la sangre es un problema, ya que diferentes poblaciones celulares tienen firmas epigenéticas distintas, pero se han desarrollado algoritmos para estimar la composición celular para superar este problema [86]. Quizás lo más importante es que las marcas epigenéticas en las células sanguíneas no necesariamente informan el estado de los tejidos de interés principal. A pesar de esto, estudios recientes han proporcionado evidencia clara de una relación entre las marcas epigenéticas en las células sanguíneas y el IMC. En el caso de HIF3A para el cual el nivel de metilación (valor beta) en la población de estudio osciló entre 0.14 y 0.52, un aumento del 10 % en la metilación se asoció con un aumento del IMC del 7.8 % [52]. Asimismo, una diferencia del 10 % en la metilación de PGC1A puede predecir hasta un 12 % de diferencia en la masa grasa [54].
 Conclusiones
Conclusiones
El estudio del papel de la epigenética en la obesidad y la enfermedad metabólica se ha expandido rápidamente en los últimos años, y se está acumulando evidencia de un vínculo entre las modificaciones epigenéticas y los resultados de la salud metabólica en los seres humanos. Los biomarcadores epigenéticos potenciales asociados con la obesidad y la salud metabólica también han surgido de estudios recientes. La validación de marcas epigenéticas en múltiples cohortes, el hecho de que varias marcas se encuentran en genes con una función plausible en la obesidad y el desarrollo de T2DM, así como la superposición de marcas epigenéticas con obesidad conocida y loci genéticos T2DM fortalece la evidencia de que estas asociaciones son real. La causalidad ha sido hasta ahora difícil de establecer; sin embargo, independientemente de si las asociaciones son causales, las marcas epigenéticas identificadas aún pueden ser relevantes como biomarcadores para obesidad y riesgo de enfermedad metabólica.
Los tamaños del efecto en tejidos fácilmente accesibles, como la sangre, son pequeños pero parecen reproducibles a pesar de la variación en el origen étnico, el tipo de tejido y los métodos de análisis [51]. Además, incluso los pequeños cambios en la metilación del ADN pueden tener un significado biológico. Un enfoque "ómico" integrador será crucial para desentrañar aún más las complejas interacciones entre el epigenoma, el transcriptoma, el genoma y la salud metabólica. Los estudios longitudinales, idealmente que abarquen varias generaciones, son esenciales para establecer relaciones causales. Podemos esperar más estudios de este tipo en el futuro, pero esto llevará tiempo.
Mientras que los estudios en animales continúan demostrando un efecto de vida temprana nutricional exposición sobre el epigenoma y la salud metabólica de la descendencia, los datos en humanos aún son limitados. Sin embargo, estudios recientes han proporcionado evidencia clara de que la exposición a una nutrición subóptima durante períodos específicos del desarrollo prenatal está asociada con cambios de metilación en la descendencia y, por lo tanto, tiene el potencial de influir en el fenotipo adulto. Los estudios en animales serán importantes para verificar los hallazgos en humanos en un entorno más controlado, ayudar a determinar si los cambios de metilación identificados tienen algún impacto en la salud metabólica y desentrañar los mecanismos subyacentes a esta regulación epigenética intergeneracional/transgeneracional. La identificación de los mecanismos causales que subyacen a las respuestas metabólicas de la memoria, el modo de transmisión de los efectos fenotípicos en generaciones sucesivas, el grado de impacto y estabilidad del rasgo transmitido y la identificación de un contexto evolutivo general y unificador también siguen siendo cuestiones importantes que deben abordarse. . Este último a menudo se resume en la hipótesis de la respuesta adaptativa predictiva, es decir, una respuesta a un entorno futuro anticipado que aumenta la aptitud de la población. Sin embargo, esta hipótesis se ha cuestionado cada vez más, ya que hay pruebas limitadas de un mayor estado físico más adelante en la vida [87].
En resumen, los resultados son prometedores, ya que los cambios epigenéticos están relacionados con la salud metabólica de los adultos y actúan como un mediador entre la nutrición prenatal alterada y el posterior aumento del riesgo de resultados deficientes de salud metabólica. Se han identificado nuevas marcas epigenéticas que se asocian con medidas de salud metabólica. La integración de diferentes capas de información genómica ha agregado un mayor apoyo a las relaciones causales, y ha habido más estudios que muestran los efectos del entorno pre y posnatal en el epigenoma y la salud. Si bien quedan muchas preguntas importantes, los recientes avances metodológicos han permitido los tipos de estudios basados en la población a gran escala que serán necesarios para abordar las lagunas de conocimiento. La próxima década promete ser un período de gran actividad en esta importante área de investigación.
Susan J. van Dijk1, Ross L. Tellam2, Janna L. Morrison3, Beverly S. Muhlhausler4,5” y Peter L. Molloy1*”
Conflicto de intereses
Los autores declaran que no tienen intereses en conflicto.
Contribuciones de los autores
Todos los autores contribuyeron a la redacción y revisión crítica del manuscrito, y todos los autores leyeron y aprobaron el manuscrito final.
Información de los autores
Beverly S. Muhlhausler y Peter L. Molloy son los últimos autores conjuntos.
Agradecimientos
Este trabajo ha sido respaldado por una subvención del Fondo de Dotación para Ciencia e Industria (Grant RP03-064). JLM y BSM cuentan con el respaldo de las becas de desarrollo profesional del Consejo Nacional de Salud e Investigación Médica (JLM, APP1066916, BSM, APP1004211). Agradecemos a Lance Macaulay y Sue Mitchell por la lectura crítica y los comentarios sobre el manuscrito.
Detalles del autor
1Insignia de Alimentos y Nutrición de CSIRO, PO Box 52, North Ryde, NSW 1670, Australia. 2Insignia agrícola de CSIRO, 306 Carmody Road, Santa Lucía, QLD 4067, Australia. 3Early Origins of Adult Health Research Group, School of Pharmacy and Medical Sciences, Sansom Institute for Health Research, University of South Australia, GPO Box 2471, Adelaide, SA 5001, Australia 4FOODplus Research Centre, Waite Campus, The University of Adelaide, PMB 1 , Glen Osmond, SA 5064, Australia. 5Instituto de Investigación sobre la Salud de la Mujer y el Niño, 72 King William Road, North Adelaide, SA 5006, Australia.
1. QUIÉN. QUIÉN | Sobrepeso y obesidad. www.who.int/gho/ncd/
risk_factors / overweight / en / index.html. Accedido a 29 enero 2015.
2. Visscher PM, Brown MA, McCarthy MI, Yang J. Cinco años de descubrimiento de GWAS.
Soy J Hum Genet. 2012;90:7–24.
3. Locke AE, Kahali B, Berndt SI, Justice AE, Pers TH, Day FR, et al. Genético
los estudios del índice de masa corporal arrojan nuevos conocimientos para la biología de la obesidad. Naturaleza.
2015;518:197–206.
4. Ling C, Del Guerra S, Lupi R, Rönn T, Granhall C, Luthman H, et al.
Regulación epigenética de PPARGC1A en islotes diabéticos de tipo humano 2 y
efecto sobre la secreción de insulina. Diabetología. 2008;51:615–22.
5. Van Dijk SJ, Molloy PL, Varinli H, Morrison JL, Muhlhausler BS. Epigenética
y la obesidad humana. Int J Obes (Londres). 2015;39:85–97.
6. Teh AL, Pan H, Chen L, Ong ML, Dogra S, Wong J, y col. El efecto de
genotipo y ambiente en el útero sobre la variación interindividual en recién nacidos
metilomas de ADN. Genoma Res. 2014;24:1064–74.
7. Olsson AH, Volkov P, Bacos K, Dayeh T, Sala E, Nilsson EA, y col. Genomewide
asociaciones entre influencia de variación genética y epigenética
Expresión de ARNm y secreción de insulina en islotes pancreáticos humanos. PLoS
Gineta. 2014; 10: e1004735.
8. Grundberg E, Meduri E, Sandling JK, Hedman AK, Keildson S, Buil A, y col.
Análisis global de la variación de la metilación del ADN en el tejido adiposo de gemelos
revela enlaces a variantes asociadas a la enfermedad en elementos reguladores distales.
Soy J Hum Genet. 2013;93:876–90.
9. Ronn T, Volkov P, Gillberg L, Kokosar M, Perfilyev A, Jacobsen AL, et al.
Impacto de los niveles de edad, IMC y HbA1c en el ADN genómico
patrones de expresión de metilación y ARNm en tejido adiposo humano
e identificación de biomarcadores epigenéticos en sangre. Hum Mol Genet.
2015;24:3792–813.
10. Waterland RA, Michels KB. Epidemiología epidemiológica del desarrollo
hipótesis de los orígenes. Anu Rev Nutr. 2007;27:363–88.
11. McMillen IC, Rattanatray L, Duffield JA, Morrison JL, MacLaughlin SM, Gentili
S, et al. Los orígenes tempranos de la obesidad posterior: vías y mecanismos. Adv
Exp Med Biol. 2009;646:71–81.
12. Ravelli A, Van der Meulen J, Michels R, Osmond C, Barker D, Hales C, y col.
Tolerancia a la glucosa en adultos después de la exposición prenatal a la hambruna. Lanceta.
1998;351:173–7.
13. McMillen IC, MacLaughlin SM, Muhlhausler BS, Gentili S, Duffield JL,
Morrison JL. Los orígenes del desarrollo de la salud y la enfermedad de adultos: el papel de
nutrición periconcepcional y fetal. Basic Clin Pharmacol Toxicol.
2008;102:82–9.
14. Zhang S, Rattanatray L, McMillen IC, Suter CM, Morrison JL. Periconcepcional
nutrición y la programación temprana de una vida de obesidad o adversidad. Prog
Biophys Mol Biol. 2011;106:307–14.
15. Bouret S, Levin BE, Ozanne SE. Interacciones gene-ambiente controlando
homeostasis de la energía y la glucosa y los orígenes del desarrollo de la obesidad.
Physiol Rev. 2015;95:47–82.
16. Borengasser SJ, Zhong Y, Kang P, Lindsey F, Ronis MJ, Badger TM, et al.
La obesidad materna mejora la diferenciación del tejido adiposo blanco y altera
Metilación del ADN a escala del genoma en la descendencia de la rata macho. Endocrinología.
2013;154:4113–25.
17. Gluckman PD, Lillycrop KA, Vickers MH, Pleasants AB, Phillips ES, Beedle AS,
et al. La plasticidad metabólica durante el desarrollo de los mamíferos es direccional
depende del estado nutricional temprano. Proc Natl Acad Sci US A.
2007;104:12796–800.
18. Godfrey KM, Sheppard A, PD Gluckman, Lillycrop KA, Burdge GC, McLean C,
et al. La metilación del promotor del gen epigenético en el nacimiento se asocia con
adiposidad posterior del niño. Diabetes. 2011;60:1528–34.
19. McMillen IC, Adam CL, Muhlhausler BS. Orígenes tempranos de la obesidad:
programar el sistema de regulación del apetito. J Physiol. 2005; 565 (Pt 1): 9-17.
20. Begum G, Stevens A, Smith EB, Connor K, Challis JR, Bloomfield F, y col.
Los cambios epigenéticos en las vías de regulación de la energía hipotalámica fetal son
asociados con la desnutrición materna y el hermanamiento. FASEB J.
2012;26:1694–703.
21. Ge ZJ, Liang QX, Hou Y, Han ZM, Schatten H, Sun QY, y col. Obesidad materna
y la diabetes pueden causar alteración de la metilación del ADN en los espermatozoides de
descendiente en ratones. Reprod Biol Endocrinol. 2014; 12: 29.
22. Jousse C, Parry L, Lambert-Langlais S, Maurin AC, Averous J, Bruhat A, et al.
La desnutrición perinatal afecta la metilación y la expresión de la leptina
gen en adultos: implicación para la comprensión del síndrome metabólico.
FASEB J. 2011;25:3271–8.
23. Lan X, Cretney EC, Kropp J, Khateeb K, Berg MA, Penagaricano F, et al.
La dieta materna durante el embarazo induce la expresión génica y el ADN
cambios de metilación en tejidos fetales en ovejas. Frente Genet. 2013; 4: 49.
24. Li CC, Young PE, Maloney CA, Eaton SA, Cowley MJ, Buckland ME, y col.
La obesidad materna y la diabetes inducen defectos metabólicos latentes y
Cambios epigenéticos generalizados en ratones isogénicos. Epigenética. 2013;8:602–11.
25. Lillycrop KA, Phillips ES, Jackson AA, Hanson MA, Burdge GC. Proteína dietética
la restricción de ratas gestantes induce y la suplementación con ácido fólico previene
modificación epigenética de la expresión génica hepática en la descendencia. J Nutr.
2005;135:1382–6.
26. Radford EJ, Ito M, Shi H, Corish JA, Yamazawa K, Isganaitis E, et al. En el útero
efectos. La desnutrición en el útero perturba el espermatozoide adulto
y metabolismo intergeneracional. Ciencia. 2014; 345 (80): 1255903.
27. Suter M, Bocock P, Showalter L, Hu M, Shope C, McKnight R, y col.
Epigenómica: la exposición de la dieta materna alta en grasa en el útero interrumpe
expresión génica circadiana periférica en primates no humanos. FASEB J.
2011;25:714–26.
28. Suter MA, Ma J, Vuguin PM, Hartil K, Fiallo A, Harris RA, et al. En el útero
la exposición a una dieta alta en grasas materna altera el código de histona epigenética en un
modelo murino. Soy J Obs Gynecol. 2014;210:463 e1–463 e11.
29. Tosh DN, Fu Q, Callaway CW, McKnight RA, McMillen IC, Ross MG, et al.
Epigenética de la obesidad programada: alteración en IUGR rata hepática IGF1
La expresión del ARNm y la estructura de la histona en el posnatal rápido frente al tardío
crecimiento compensatorio. Am J Physiol Gastrointest Liver Physiol.
2010;299:G1023–9.
30. Sandovici I, Smith NH, Nitert MD, Ackers-Johnson M, Uribe-Lewis S, Ito Y,
et al. La dieta y el envejecimiento de la madre alteran el control epigenético de un estimulante mejorador
interacción en el gen Hnf4a en islotes pancreáticos de rata. Proc Natl
Acad Sci US A. 2011;108:5449–54.
31. Braunschweig M, Jagannathan V, Gutzwiller A, Bee G. Investigaciones sobre
respuesta epigenética transgeneracional en la línea masculina en cerdos F2. PLoS
Uno. 2012; 7, e30583.
32. Carone BR, Fauquier L, Habib N, Shea JM, Hart CE, Li R, et al. Paternalmente
reprogramación ambiental transgeneracional inducida de metabolismo
expresión génica en mamíferos. Celúla. 2010;143:1084–96.
33. Ost A, Lempradl A, Casas E, Weigert M, Tiko T, Deniz M, et al. Dieta paterna
define el estado de cromatina descendiente y la obesidad intergeneracional. Celda.
2014;159:1352–64.
34. MartÃnez D, Pentinat T, Ribó S, Daviaud C, Bloks VW, Cebrià J, et al. En el útero
desnutrición en ratones machos programa metabolismo de lípidos hepáticos en la segunda generación
descendientes que implican metilación de ADN Lxra alterada. Cell Metab.
2014;19:941–51.
35. Wei Y, Yang CR, Wei YP, Zhao ZA, Hou Y, Schatten H, y col. Paternalmente
herencia transgeneracional inducida de la susceptibilidad a la diabetes en
mamíferos. Proc Natl Acad Sci US A. 2014;111:1873–8.
36. Grossniklaus U, Kelly WG, Kelly B, Ferguson-Smith AC, Pembrey M, Lindquist
S. Herencia epigenética transgeneracional: ¿qué tan importante es? Nat Rev
Gineta. 2013;14:228–35.
37. Pembrey M, Saffery R, Bygren LO. Respuestas transgeneracionales humanas a
experiencia temprana de la vida: impacto potencial en el desarrollo, la salud y
investigación biomédica. J Med Genet. 2014;51:563–72.
38. Wolff GL, Kodell RL, Moore SR, Cooney CA. Epigenética materna y metilo
suplementos afectan la expresión del gen agouti en ratones Avy / a. FASEB J.
1998;12:949–57.
39. Jirtle RL, Skinner MK. Epigenómica ambiental y susceptibilidad a enfermedades.
Nat Rev. Genet. 2007;8:253–62.
40. Morgan HD, Sutherland HG, Martin DI, Whitelaw E. herencia epigenética en
el locus agutí en el ratón. Nat Genet. 1999;23:314–8.
41. Cropley JE, Suter CM, Beckman KB, Martin DI. Germinales epigenéticos
modificación del alelo A vy murino mediante suplementación nutricional. Proc
Natl Acad Sci US A. 2006;103:17308–12.
42. Hoile SP, Lillycrop KA, Thomas NA, Hanson MA, Burdge GC. Proteína dietética
la restricción durante el embarazo F0 en ratas induce cambios transgeneracionales en
el transcriptoma hepático en la descendencia femenina. Más uno. 2011; 6, e21668.
43. Multhaup ML, Seldin MM, Jaffe AE, Lei X, Kirchner H, Mondal P, y col. Mousehuman
análisis epigenético experimental desenmascara objetivos dietéticos y
responsabilidad genética de los fenotipos diabéticos. Metab. celular 2015;21:138–49.
44. Michels KB, Binder AM, Dedeurwaerder S, Epstein CB, Greally JM, Gut I, et al.
Recomendaciones para el diseño y análisis de todo el epigenoma
estudios de asociación. Métodos Nat. 2013;10:949–55.
45. Dayeh TA, Olsson AH, Volkov P, Almgren P, Rönn T, Ling C. Identificación de
CpG-SNP asociados con la diabetes tipo 2 y la metilación diferencial del ADN
en islotes pancreáticos humanos. Diabetología. 2013;56:1036–46.
46. Relton CL, Davey Smith G. Aleatorización mendeliana epigenética en dos pasos: a
estrategia para establecer el papel causal de los procesos epigenéticos en las vías
a la enfermedad Int J Epidemiol. 2012;41:161–76.
47. Liu Y, Aryee MJ, Padyukov L, Fallin MD, Hesselberg E, Runarsson A, et al.
Los datos de asociación de todo el Epigenoma implican la metilación del ADN como una
intermediario del riesgo genético en la artritis reumatoide. Nat Biotechnol.
2013;31:142–7.
48. Yuan W, Xia Y, Bell CG, Sin embargo, I, Ferreira T, Ward KJ, et al. Un integrado
Análisis epigenómico para los loci de susceptibilidad a la diabetes tipo 2 en monocigóticos
Gemelos. Nat Commun. 2014; 5: 5719.
49. Nitert MD, Dayeh T, Volkov P, Elgzyri T, Hall E, Nilsson E, et al. Impacto de un
intervención de ejercicio en la metilación del ADN en el músculo esquelético de firstdegree
familiares de pacientes con diabetes tipo 2. Diabetes. 2012;61:3322–32.
50. Gagnon F, Aïssi D, Carrié A, Morange PE, Trégouët DA. Validación robusta de
Asociación de niveles de metilación en el locus CPT1A con niveles plasmáticos de lípidos.
Res. de lípidos J. 2014;55:1189–91.
51. Demerath EW, Guan W, Grove ML, Aslibekyan S, Mendelson M, Zhou YH,
et al. El estudio de asociación de epigenoma completo (EWAS) de IMC, cambio de IMC y
circunferencia de la cintura en adultos afroamericanos identifica múltiples replicados
lugares Hum Mol Genet. 2015:ddv161–.
52. Dick KJ, Nelson CP, Tsaprouni L, Sandling JK, Aïssi D, Wahl S, et al. ADN
metilación e índice de masa corporal: un análisis genómico completo. Lanceta.
2014;6736:1–9.
53. Su S, Zhu H, Xu X, Wang X, Dong Y, Kapuku G, y col. Metilación del ADN de
el gen LY86 se asocia con obesidad, resistencia a la insulina y
inflamación. Gemela Res Hum Genet. 2014;17:183–91.
54. Clarke-Harris R, Wilkin TJ, Hosking J, Pinkney J, Jeffery AN, Metcalf BS, et al.
La metilación del promotor de PGC1α en la sangre a los 5-7 años predice la adiposidad de
9 a 14 años (EarlyBird 50). Diabetes. 2014;63:2528–37.
55. Guay SP, Brisson D, Lamarche B, Biron S, Lescelleur O, Biertho L, y col.
ADRB3 promotor del gen Metilación del ADN en sangre y adiposidad visceral
el tejido se asocia con alteraciones metabólicas en los hombres. Epigenomics.
2014;6:33–43.
56. Agha G, Houseman EA, Kelsey KT, Eaton CB, Buka SL, Loucks EB. La adiposidad es
asociado con el perfil de metilación del ADN en el tejido adiposo. Int J Epidemiol.
2014: 1-11.
57. Irvin MR, Zhi D, Joehanes R, Mendelson M, Aslibekyan S, Claas SA, et al.
Epigenoma todo el estudio de asociación de lípidos en sangre en ayunas en la genética de
Medicamentos hipolipemiantes y estudio de red dietética. Circulación. 2014;130:565–72.
58. Frazier-Wood AC, Aslibekyan S, Absher DM, Hopkins PN, Sha J, Tsai MY, y col.
La metilación en el locus CPT1A se asocia con la subfracción de lipoproteínas
perfiles. Res. de lípidos J. 2014;55:1324–30.
59. Pfeifferm L, Wahl S, Pilling LC, Reischl E, Sandling JK, Kunze S, et al. ADN
la metilación de los genes relacionados con los lípidos afecta los niveles de lípidos en la sangre. Circ Cardiovasc
Gineta. 2015.
60. Petersen AK, Zeilinger S, Kastenmüller G, Römisch-Margl W, Brugger M, Peters
A, et al. La epigenética se encuentra con la metabolómica: una asociación en todo el epigenoma
estudio con características metabólicas del suero sanguíneo. Hum Mol Genet. 2014;23:534–45.
61. Hidalgo B, Irvin MR, Sha J, Zhi D, Aslibekyan S, Absher D, y col. Epigenomewide
estudio de asociación de las medidas de glucosa, insulina y HOMA-IR en ayunas
en la genética de los fármacos hipolipemiantes y en el estudio de la red de dietas. Diabetes.
2014;63:801–7.
62. Dayeh T, Volkov P, Salö S, Hall E, Nilsson E, Olsson AH, et al. En todo el genoma
Análisis de metilación del ADN de islotes pancreáticos humanos del tipo 2 diabéticos
y los donantes no diabéticos identifican los genes candidatos que influyen en la insulina
secreción. PLoS Genet. 2014; 10, e1004160.
63. Nilsson E, Jansson PA, Perfilyev A, Volkov P, Pedersen M, Svensson MK, y col.
Metilación alterada del ADN y expresión diferencial de genes que influyen
metabolismo e inflamación en el tejido adiposo de sujetos con el tipo 2
diabetes. Diabetes. 2014;63:2962–76.
64. Benton MC, Johnstone A, Eccles D, Harmon B, Hayes MT, Lea RA, et al. Un análisis de la metilación del ADN en el tejido adiposo humano revela una modificación diferencial de los genes de la obesidad antes y después del bypass gástrico y el peso
pérdida. Gene. 2015;16:1–21.
65. Bateson P, Gluckman P. plasticidad y robustez en el desarrollo y
evolución. Int J Epidemiol. 2012;41:219–23.
66. Feinberg AP, Irizarry RA, Feinberg AP, Irizarry RA. Evolución en salud y
Colloquium de Sackler de medicina: variación epigenética estocástica como conducción
fuerza de desarrollo, adaptación evolutiva y enfermedad. Proc Natl Acad
Sci US A. 2010;107 (suplemento): 1757–64.
67. Martino D, Loke YJ, Gordon L, Ollikainen M, Cruickshank MN, Saffery R, y col.
Análisis longitudinal a escala del genoma de la metilación del ADN en gemelos desde el nacimiento
a 18 meses de edad revela un cambio epigenético rápido en la vida temprana y paresespecíficos
efectos de la discordancia Genoma Biol. 2013; 14: R42.
68. Tobi EW, Goeman JJ, Monajemi R, Gu H, Putter H, Zhang Y, et al. ADN
las firmas de metilación vinculan la exposición al hambre prenatal con el crecimiento y
metabolismo. Nat Commun. 2014; 5: 5592.
69. Dominguez-Salas P, Moore SE, Baker MS, Bergen AW, Cox SE, Dyer RA, y col.
La nutrición materna en la concepción modula la metilación del ADN de humanos
epialleles metaestables. Nat Commun. 2014; 5: 3746.
70. Quilter CR, Cooper WN, Cliffe KM, Skinner BM, Prentice PM, Nelson L, y col.
Impacto en los patrones de metilación de la descendencia de la diabetes gestacional materna
mellitus y la restricción del crecimiento intrauterino sugieren genes comunes y
vías vinculadas al riesgo subsiguiente de diabetes tipo 2. FASEB J. 2014: 1–12.
71. Morales E, novio A, Lawlor DA, Relton CL. Firmas de metilación del ADN en
sangre del cordón umbilical asociada con el aumento de peso gestacional materno: resultados de
la cohorte ALSPAC. BMC Res Notes. 2014; 7: 278.
72. Ruchat SM, Houde AA, Voisin G, St-Pierre J, Perron P, Baillargeon JP, y col.
La diabetes mellitus gestacional afecta epigeneticamente a los genes predominantemente
implicados en enfermedades metabólicas. Epigenética. 2013;8:935–43.
73. Liu X, Chen Q, Tsai HJ, Wang G, Hong X, Zhou Y, y col. Materno
índice de masa corporal preconcepcional y ADN de sangre de cordón descendente
metilación: exploración de los orígenes de la vida temprana de la enfermedad. Environ Mol
Mutageno. 2014;55:223–30.
74. Soubry A, Murphy SK, Wang F, Huang Z, Vidal AC, Fuemmeler BF, et al.
Los recién nacidos de padres obesos han alterado los patrones de metilación del ADN en
genes impresos. Int J Obes (Londres). 2015;39:650–7.
75. Jacobsen SC, Brøns C, Bork-Jensen J, Ribel-Madsen R, Yang B, Lara E, et al.
Efectos de la sobrealimentación de alto contenido graso a corto plazo en el ADN genómico
metilación en el músculo esquelético de hombres jóvenes sanos. Diabetologia.
2012;55:3341–9.
76. Gillberg L, Jacobsen SC, Rönn T, Brøns C, Vaag A. PPARGC1A ADN
Metilación en tejido adiposo subcutáneo en sujetos con bajo peso al nacer.
impacto de 5 días de sobrealimentación rica en grasas. Metabolismo. 2014;63:263–71.
77. Huang YT, Maccani JZJ, Hawley NL, Wing RR, Kelsey KT, McCaffery JM.
Patrones epigenéticos en mantenedores de pérdida de peso exitosos: un estudio piloto. Int J
Obes (Londres). 2015;39:865–8.
78. Barres R, Kirchner H, Rasmussen M, Yan J, Kantor FR, Krook A, Näslund E,
Zierath JR. Pérdida de peso después de la cirugía de derivación gástrica en la obesidad humana
remodela la metilación del promotor. Representante celular 2013: 1-8.
79. Ahrens M, Ammerpohl O, von Schönfels W, Kolarova J, Bens S, Itzel T, et al.
El análisis de metilación del ADN en la enfermedad de hígado graso no alcohólico sugiere
distintas firmas específicas de enfermedad y remodelación después de la cirugía bariátrica.
Metab. celular 2013;18:296–302.
80. Voisin S, Eynon N, Yan X, obispo DJ. Entrenamiento físico y metilación del ADN
Inhumanos. Acta Physiol (Oxf). 2014;213:39–59.
81. Lindholm ME, Marabita F, Gomez-Cabrero D, Rundqvist H, Ekström TJ,
Tegnér J, et al. Un análisis integrador revela una reprogramación coordinada
del epigenoma y el transcriptoma en el músculo esquelético humano después
capacitación. Epigenética. 2014;9:1557–69.
82. Denham J, O'Brien BJ, Marques FZ, Charchar FJ. Cambios en el leucocito
methylome y su efecto sobre los genes cardiovasculares después del ejercicio.
J Appl Physiol. 2014: jap.00878.2014.
83. Rowlands DS, Page RA, Sukala WR, Giri M, Ghimbovschi SD, Hayat I, et al.
Las redes integradas multiméricas conectan la metilación del ADN y miRNA con
plasticidad del músculo esquelético al ejercicio crónico en la obesidad diabética tipo 2.
Physiol Genómica. 2014;46:747–65.
84. Horvath S, Erhart W, Brosch M, Ammerpohl O, von Schonfels W, Ahrens M,
et al. La obesidad acelera el envejecimiento epigenético del hígado humano. Proc Natl Acad
ciencia 2014;111:15538–43.
85. Almén MS, Nilsson EK, Jacobsson JA, Kalnina I, Klovins J, Fredriksson R, et al.
El análisis del genoma revela marcadores de metilación del ADN que varían con
tanto la edad como la obesidad. Gene. 2014.;548:61–7
86. Houseman EA, Molitor J, Marsit CJ. Ajustes de mezcla de celda libre de referencia
en el análisis de los datos de metilación del ADN. Bioinformática. 2014;30:1431–9.
87. Wells JC. Una evaluación crítica de la hipótesis de respuesta adaptativa predictiva.
Int J Epidemiol. 2012;41:229–35.
88. Williams-Wyss O, Zhang S, MacLaughlin SM, Kleemann D, Walker SK, Suter
CM, y col. Número de embriones y desnutrición periconcepcional en el
las ovejas tienen efectos diferenciales en el epigenotipo suprarrenal, crecimiento y
desarrollo. Soy J Physiol Endocrinol Metab. 2014;307:E141–50.
89. Zhang S, Rattanatray L, Morrison JL, Nicholas LM, Lie S, McMillen IC.
La obesidad materna y los orígenes tempranos de la obesidad infantil: ponderar
los beneficios y costos de la pérdida de peso materna en el periconcepcional
período para la descendencia. Exp Diabetes Res. 2011; 2011: 585749.
90. Zhang S, Williams-Wyss O, MacLaughlin SM, Walker SK, Kleemann DO, Suter
CM, y col. Desnutrición materna durante la primera semana después de la concepción
resultados en la disminución de la expresión del ARNm del receptor de glucocorticoides en el
ausencia de hipermetilación del exón GR 17 en la hipófisis fetal a fines del
gestación. J Dev Orig Heal Dis. 2013;4:391–401.
91. Lie S, Morrison JL, Williams-Wyss O, Suter CM, Humphreys DT, Ozanne SE,
et al. Programas de desnutrición periconcepcional cambios en la señalización de la insulina
moléculas y microRNAs en el músculo esquelético en singleton y fetal gemelar
oveja. Biol Reprod. 2014; 90: 5.
92. Van Straten EM, Van Meer H, Huijkman NC, Van Dijk TH, Baller JF, Verkade
HJ, y col. La activación del receptor X hepático fetal induce agudamente lipogénesis, pero
no afecta la respuesta de los lípidos en plasma a una dieta alta en grasas en ratones adultos. Am J
Physiol Endocrinol Metab. 2009;297:E1171–8.
93. Fernández-Twinn DS, Alfaradhi MZ, Martin-Gronert MS, Duque-Guimaraes
DE, Piekarz A, Ferland-McCollough D, et al. Regulación descendente de IRS-1 en
tejido adiposo de la descendencia de ratones obesos se programa cellautonomously
a través de mecanismos postranscripcionales. Mol Metab.
2014;3:325–33.
94. Waterland RA, Travisano M, Tahiliani KG. La hipermetilación inducida por la dieta en
agouti amarillo viable no se hereda transgeneracionalmente a través de la hembra.
FASEB J. 2007;21:3380–5.
95. Ge ZJ, Luo SM, Lin F, Liang QX, Huang L, Wei YC, y col. Metilación del ADN en
ovocitos e hígado de ratones hembras y sus crías: efectos de altos niveles de grasa y dietinduced
obesidad. Env Heal Perspectiva. 2014;122:159–64.
96. Ollikainen M, Ismail K, Gervin K, Kyllönen A, Hakkarainen A, Lundbom J, et al.
Alteraciones de la metilación del ADN en sangre en todo el genoma en elementos reguladores
y regiones heterocromáticas en gemelos monocigóticos discordantes para la obesidad
y grasa de hígado. Clin Epigenética. 2015;7:1–13.
Publicar descargos de responsabilidad
Alcance de la práctica profesional *
La información aquí contenida en "El papel de la epigenética en la obesidad y la enfermedad metabólica" no pretende reemplazar una relación personal con un profesional de la salud calificado o un médico con licencia y no es un consejo médico. Lo alentamos a que tome decisiones de atención médica basadas en su investigación y asociación con un profesional de la salud calificado.
Información del blog y debates sobre el alcance
Nuestro alcance informativo se limita a la quiropráctica, musculoesquelética, medicina física, bienestar, contribuyendo etiológico alteraciones viscerosomáticas dentro de las presentaciones clínicas, la dinámica clínica del reflejo somatovisceral asociado, los complejos de subluxación, los problemas de salud delicados y/o los artículos, temas y debates de medicina funcional.
Brindamos y presentamos colaboración clínica con especialistas de diversas disciplinas. Cada especialista se rige por su ámbito de práctica profesional y su jurisdicción de licencia. Utilizamos protocolos funcionales de salud y bienestar para tratar y apoyar la atención de lesiones o trastornos del sistema musculoesquelético.
Nuestros videos, publicaciones, temas, asuntos e ideas cubren cuestiones clínicas, problemas y temas que se relacionan y respaldan directa o indirectamente nuestro ámbito de práctica clínica.*
Nuestra oficina ha intentado razonablemente proporcionar citas de apoyo y ha identificado el estudio o los estudios de investigación relevantes que respaldan nuestras publicaciones. Proporcionamos copias de los estudios de investigación de respaldo disponibles para las juntas reguladoras y el público a pedido.
Entendemos que cubrimos asuntos que requieren una explicación adicional de cómo puede ayudar en un plan de atención o protocolo de tratamiento en particular; por lo tanto, para discutir más a fondo el tema anterior, no dude en preguntar Dr. Alex Jiménez, DC, o póngase en contacto con nosotros en 915-850-0900.
Estamos aquí para ayudarlo a usted y a su familia.
Bendiciones
El Dr. Alex Jimenez corriente continua MSACP, enfermero*, CCCT, IFMCP*, CIFM*, ATN*
email: coach@elpasomedicinafuncional.com
Licenciado como Doctor en Quiropráctica (DC) en Texas & New Mexico*
Número de licencia de Texas DC TX5807, Nuevo México DC Número de licencia NM-DC2182
Licenciada como Enfermera Registrada (RN*) en Florida
Licencia de Florida N.° de licencia de RN RN9617241 (Control No. 3558029)
Estado compacto: Licencia multiestatal: Autorizado para ejercer en 40 Estados*
Matriculado actualmente: ICHS: MSN* FNP (Programa de enfermera practicante familiar)
Dr. Alex Jiménez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Mi tarjeta de presentación digital



 (i) Cambios epigenéticos en los descendientes asociados con la nutrición materna durante la gestación
(i) Cambios epigenéticos en los descendientes asociados con la nutrición materna durante la gestación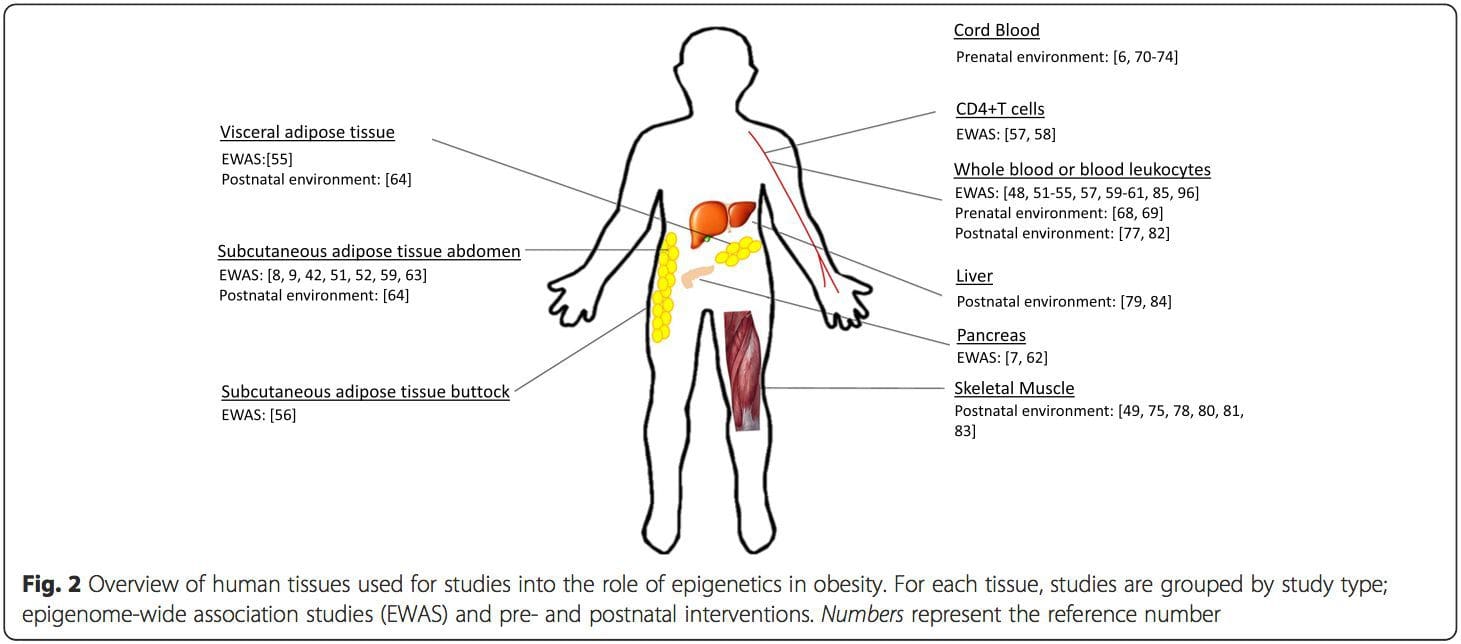 Conclusiones
Conclusiones


 De nuevo te doy la bienvenida.
De nuevo te doy la bienvenida.
Los comentarios están cerrados.