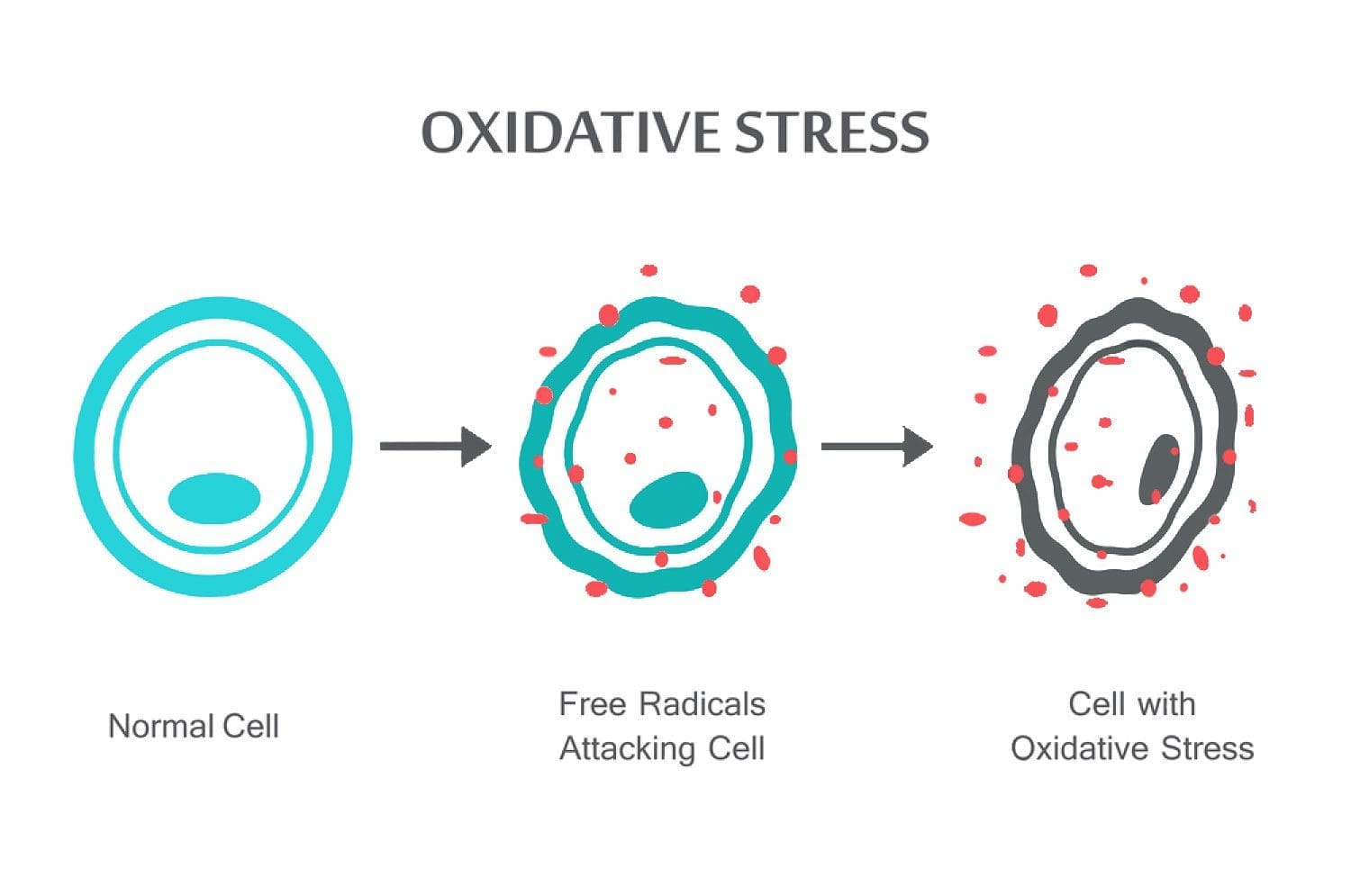
Quiropráctico basado en la ciencia Dr. Alexander Jimenez Echa un vistazo a estrés oxidativo, lo que es, cómo afecta el cuerpo y la defensa antioxidante para remediar la situación.
Esra Birben PhD, 1 Umit Murat Sahiner MD, 1 Cansin Sackesen MD, 1 Serpil Erzurum MD, 2 y Omer Kalayci, MD1
Resumen: Las especies reactivas de oxígeno (ROS) son producidas por organismos vivos como resultado del metabolismo celular normal y factores ambientales, como los contaminantes del aire o el humo del cigarrillo. Las ROS son moléculas altamente reactivas y pueden dañar estructuras celulares como carbohidratos, ácidos nucleicos, lípidos y proteínas y alterar sus funciones. El cambio en el equilibrio entre oxidantes y antioxidantes a favor de los oxidantes se denomina “estrés oxidativo”. La regulación del estado reductor y oxidante (redox) es fundamental para la viabilidad, activación, proliferación y función orgánica de las células. Los organismos aeróbicos tienen sistemas antioxidantes integrados, que incluyen antioxidantes enzimáticos y no enzimáticos que suelen ser eficaces para bloquear los efectos nocivos de las ROS. Sin embargo, en condiciones patológicas, los sistemas antioxidantes pueden verse abrumados. El estrés oxidativo contribuye a muchas condiciones patológicas y enfermedades, incluyendo cáncer, trastornos neurológicos, aterosclerosis, hipertensión, isquemia/perfusión, diabetes, síndrome de dificultad respiratoria aguda, fibrosis pulmonar idiopática, enfermedad pulmonar obstructiva crónica y asma. En esta revisión, resumimos los sistemas celulares oxidantes y antioxidantes y discutimos los efectos celulares y los mecanismos del estrés oxidativo.
Palabras clave: antioxidante, oxidante, estrés oxidativo, especies reactivas de oxígeno, redox
(Diario WAO 2012; 5:9-19)
Las especies reactivas de oxígeno (ROS) son producidas por organismos vivos como resultado del metabolismo celular normal. En concentraciones bajas a moderadas, funcionan en procesos celulares fisiológicos, pero en concentraciones altas producen modificaciones adversas en los componentes celulares, como lípidos, proteínas y ADN.1–6 El cambio en el equilibrio entre oxidante/antioxidante a favor de oxidantes se denomina “estrés oxidativo”. El estrés oxidativo contribuye a muchas condiciones patológicas, incluyendo cáncer, trastornos neurológicos,7–10 aterosclerosis, hipertensión, isquemia/perfusión,11–14 diabetes, síndrome de dificultad respiratoria aguda, fibrosis pulmonar idiopática , enfermedad pulmonar obstructiva crónica,15 y asma.16–21 Los organismos aeróbicos tienen sistemas antioxidantes integrados, que incluyen antioxidantes enzimáticos y no enzimáticos que suelen ser efectivos para bloquear los efectos nocivos de las ROS. Sin embargo, en condiciones patológicas, los sistemas antioxidantes pueden verse abrumados. En esta revisión, resumimos los sistemas celulares oxidantes y antioxidantes y la regulación del estado reductor y oxidante (redox) en estados de salud y enfermedad.
OXIDANTES
Fuentes endógenas de ROS
Los ROS se producen a partir de oxígeno molecular como resultado del metabolismo celular normal. Los ROS se pueden dividir en grupos 2: radicales libres y no radicales. Las moléculas que contienen uno o más electrones no emparejados y dando así reactividad a la molécula se llaman radicales libres. Cuando los radicales libres 2 comparten sus electrones no apareados, se crean formas no radicales. Los 3 principales ROS que tienen importancia fisiológica son el anión superóxido (O22.), El radical hidroxilo (OH) y el peróxido de hidrógeno (H2O2). ROS se resumen en la Tabla 1.
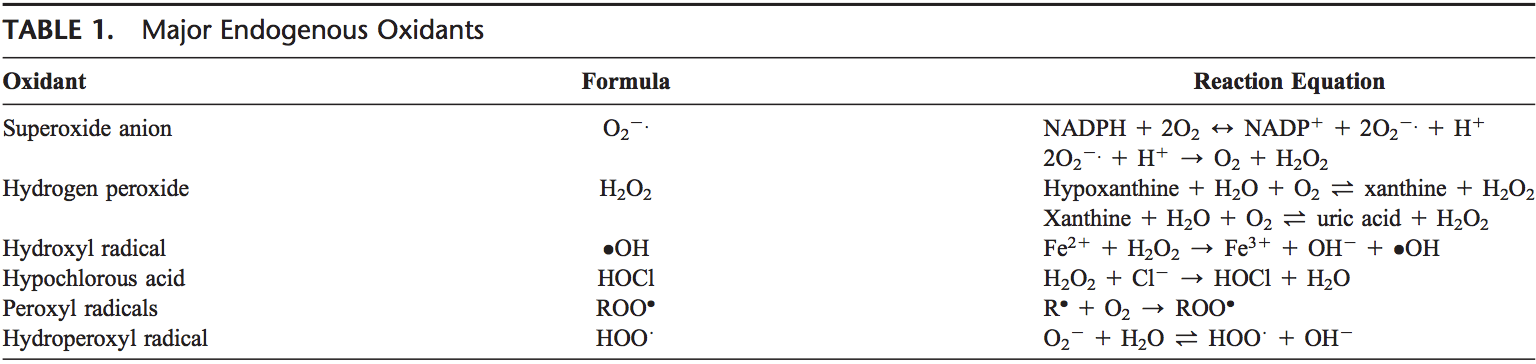 El anión superóxido se forma mediante la adición de 1 electrón al oxígeno molecular.22 Este proceso está mediado por la nicotina adenina dinucleótido fosfato [NAD(P)H] oxidasa o xantina oxidasa o por el sistema de transporte de electrones mitocondrial. El sitio principal para producir anión superóxido es la mitocondria, la maquinaria de la célula para producir trifosfato de adenosina. Normalmente, los electrones se transfieren a través de la cadena de transporte de electrones mitocondrial para la reducción de oxígeno a agua, pero aproximadamente del 1 al 3% de todos los electrones se escapan del sistema y producen superóxido. La NAD(P)H oxidasa se encuentra en leucocitos polimorfonucleares, monocitos y macrófagos. Tras la fagocitosis, estas células producen una explosión de superóxido que conduce a la actividad bactericida. El superóxido se convierte en peróxido de hidrógeno por la acción de las superóxido dismutasas (SOD, EC 1.15.1.1). El peróxido de hidrógeno se difunde fácilmente a través de la membrana plasmática. El peróxido de hidrógeno también es producido por la xantina oxidasa, la aminoácido oxidasa y la NAD(P)H oxidasa 23,24 y en los peroxisomas por el consumo de oxígeno molecular en reacciones metabólicas. En una sucesión de reacciones llamadas reacciones de Haber-Weiss y Fenton, el H2O2 puede descomponerse en OH2 en presencia de metales de transmisión como Fe21 o Cu21.25
El anión superóxido se forma mediante la adición de 1 electrón al oxígeno molecular.22 Este proceso está mediado por la nicotina adenina dinucleótido fosfato [NAD(P)H] oxidasa o xantina oxidasa o por el sistema de transporte de electrones mitocondrial. El sitio principal para producir anión superóxido es la mitocondria, la maquinaria de la célula para producir trifosfato de adenosina. Normalmente, los electrones se transfieren a través de la cadena de transporte de electrones mitocondrial para la reducción de oxígeno a agua, pero aproximadamente del 1 al 3% de todos los electrones se escapan del sistema y producen superóxido. La NAD(P)H oxidasa se encuentra en leucocitos polimorfonucleares, monocitos y macrófagos. Tras la fagocitosis, estas células producen una explosión de superóxido que conduce a la actividad bactericida. El superóxido se convierte en peróxido de hidrógeno por la acción de las superóxido dismutasas (SOD, EC 1.15.1.1). El peróxido de hidrógeno se difunde fácilmente a través de la membrana plasmática. El peróxido de hidrógeno también es producido por la xantina oxidasa, la aminoácido oxidasa y la NAD(P)H oxidasa 23,24 y en los peroxisomas por el consumo de oxígeno molecular en reacciones metabólicas. En una sucesión de reacciones llamadas reacciones de Haber-Weiss y Fenton, el H2O2 puede descomponerse en OH2 en presencia de metales de transmisión como Fe21 o Cu21.25
Fe31 + .O2 â†'Fe2 + O2 Haber Weiss
Fe2 + H2O2 â†'Fe3 + OH + .OH Reacción de Fenton
El propio O 2 Â también puede reaccionar con H2 O2 y generar OHÂ .26,27 El radical hidroxilo es el más reactivo de las ROS y puede dañar las proteínas, los lípidos y los carbohidratos y el ADN. También puede iniciar la peroxidación lipídica tomando un electrón de los ácidos grasos poliinsaturados.
Las enzimas granulocíticas amplían aún más la reactividad del H2O2 a través de la peroxidasa de eosinófilos y la mieloperoxidasa (MPO). En los neutrófilos activados, la MPO consume H2O2. En presencia de iones de cloruro, el H2O2 se convierte en ácido hipocloroso (HOCl). El HOCl es altamente oxidativo y juega un papel importante en la destrucción de los patógenos en las vías respiratorias.28 Sin embargo, el HOCl también puede reaccionar con el ADN e inducir interacciones ADN-proteína y producir productos de oxidación de pirimidina y agregar cloruro a las bases del ADN.29,30 Eosinófilos la peroxidasa y la MPO también contribuyen al estrés oxidativo mediante la modificación de proteínas por halogenaciones, nitración y enlaces cruzados de proteínas a través de radicales tirosilo.31–33
Otros radicales libres derivados del oxígeno son los radicales peroxilo (ROO $). La forma más simple de estos radicales es el radical hidroperoxil (HOO $) y tiene un papel en la peroxidación de ácidos grasos. Los radicales libres pueden desencadenar reacciones en cadena de la peroxidación lipídica mediante la extracción de un átomo de hidrógeno de un carbono metileno de cadena lateral. El radical lipídico reacciona con el oxígeno para producir el radical peroxilo. El radical peroxilo inicia una reacción en cadena y transforma ácidos grasos poliinsaturados en hidroperóxidos lipídicos. Los hidroperóxidos de lípidos son muy inestables y se descomponen fácilmente en productos secundarios, tales como aldehídos (tales como 4-hidroxi-2,3-nonenal) y malondialdehídos (MDA). Los isoprostanos son otro grupo de productos de peroxidación de lípidos que se generan a través de la peroxidación del ácido araquidónico y también se ha encontrado que están elevados en el plasma y condensados de asma de los asmáticos.34,35 La peroxidación de lípidos perturba la integridad de las membranas celulares y conduce al reordenamiento de la estructura de membrana .
El peróxido de hidrógeno, el radical superóxido, el glutatión oxidado (GSSG), los MDA, los isoprostanos, los carbonilos y la nitrotirosina se pueden medir fácilmente a partir de muestras de lavado de plasma, sangre o broncoalveolar como biomarcadores de oxidación mediante ensayos estandarizados.
Fuente Exógena de Oxidantes
Humo de cigarro
El humo del cigarrillo contiene muchos oxidantes y radicales libres y compuestos orgánicos, como el superóxido y el óxido nítrico. Además, la inhalación de humo de cigarrillo en el pulmón también activa algunos mecanismos endógenos, como la acumulación de neutrófilos y macrófagos, lo que aumenta aún más la lesión oxidante .
Exposición al ozono
La exposición al ozono puede causar peroxidación de lípidos e inducir la afluencia de neutrófilos al epitelio de las vías respiratorias. La exposición a corto plazo al ozono también causa la liberación de mediadores inflamatorios, como la MPO, las proteínas catiónicas eosinófilas y también la lactato deshidrogenasa y la albúmina. 37 Incluso en sujetos sanos, la exposición al ozono causa una reducción de las funciones pulmonares. 38 Cho et al39 han demostrado que partículas (mezcla de partículas sólidas y gotas líquidas suspendidas en el aire) cataliza la reducción del oxígeno.
Hiperoxia
La hiperoxia se refiere a condiciones de niveles de oxígeno más altos que la presión parcial normal de oxígeno en los pulmones u otros tejidos corporales. Conduce a una mayor producción de especies reactivas de oxígeno y nitrógeno.40,41
Radiación ionizante
La radiación ionizante, en presencia de O2, convierte el radical hidroxilo, el superóxido y los radicales orgánicos en peróxido de hidrógeno e hidroperóxidos orgánicos. Estas especies de hidroperóxido reaccionan con iones metálicos redox activos, como Fe y Cu, a través de reacciones de Fenton y, por lo tanto, inducen estrés oxidativo.42,43 Narayanan et al44 demostraron que los fibroblastos que estaban expuestos a partículas alfa tenían aumentos significativos en O2 2 intracelular y H2O2. producción a través de la NADPH oxidasa unida a la membrana plasmática.44 Moléculas de transducción de señales, como las quinasas 1 y 2 reguladas por señales extracelulares (ERK1/2), la quinasa N-terminal c-Jun (JNK) y p38, y factores de transcripción, como se activan la proteÃna activadora 1 (AP-1), el factor nuclear kB (NF-kB) y p53, lo que da como resultado la expresión de genes relacionados con la respuesta a la radiación.45-50 Los fotones ultravioleta A (UVA) desencadenan reacciones oxidativas por excitación de fotosensibilizadores endógenos, como porfirinas, NADPH oxidasa y riboflavinas. La 8-oxo-7,8-dihidroguanina (8-oxoGua) es el principal producto de oxidación del ADN mediado por UVA formado por la oxidación del radical OH, oxidantes de 1 electrón y oxígeno singulete que reacciona principalmente con la guanina.51 La formación de guanina Se ha demostrado que el catión radical en el ADN aislado se produce de manera eficiente a través del efecto directo de la radiación ionizante.52,53 Después de la exposición a la radiación ionizante, el nivel intracelular de glutatión (GSH) disminuye durante un corto plazo, pero luego vuelve a aumentar.54
Iones de metales pesados
Los iones de metales pesados, como el hierro, el cobre, el cadmio, el mercurio, el níquel, el plomo y el arsénico, pueden inducir la generación de radicales reactivos y causar daño celular por agotamiento de las actividades enzimáticas a través de la peroxidación lipídica y la reacción con proteínas nucleares y ADN.
Uno de los mecanismos más importantes de generación de radicales libres mediada por metales es a través de una reacción de tipo Fenton. El ion superóxido y el peróxido de hidrógeno pueden interactuar con los metales de transición, como el hierro y el cobre, a través de la reacción de Haber-Weiss/Fenton catalizada por metales para formar radicales OH.
Metal31 1 $ O2 / Metal21 1 O2 Haber Weiss Metal21 1 H2 O2 / Metal31 1 OH 2 1 $ OH Reacción de Fenton
Además de los mecanismos tipo Fenton y tipo Haber-Weiss, ciertos iones metálicos pueden reaccionar directamente con moléculas celulares para generar radicales libres, como los radicales tiol, o inducir vías de señalización celular. Estos radicales también pueden reaccionar con otras moléculas de tiol para generar O22.. O22. se convierte en H2O2, lo que provoca la generación adicional de radicales de oxígeno. Algunos metales, como el arsenito, inducen la formación de ROS indirectamente mediante la activación de sistemas de producción de radicales en las células.56
El arsénico es un elemento altamente tóxico que produce una variedad de ROS, incluido el superóxido (O2 2), el oxígeno singulete (1O2), el radical peroxilo (ROO), el óxido nítrico (NO), el peróxido de hidrógeno (H2O2) y los radicales peroxilo dimetilarsínicos [( CH3)2AsOO].57–59 Los compuestos de arsénico (III) pueden inhibir las enzimas antioxidantes, especialmente las enzimas dependientes de GSH, como las glutatión-S-transferasas (GST), la glutatión peroxidasa (GSH-Px) y la GSH reductasa, a través de uniéndose a sus grupos sulfhidrilo (–SH).60,61
El plomo incrementa la peroxidación lipídica. 62 Se han reportado disminuciones significativas en la actividad de la SOD de tejidos y del cerebro GPx después de la exposición al plomo. 63,64 El reemplazo del zinc, que actúa como cofactor para muchas enzimas por plomo, conduce a la inactivación de tales enzimas. La exposición al plomo puede causar la inhibición del GST al afectar a los tioles del tejido.
Los ROS generados por reacciones catalizadas con metal pueden modular las bases de ADN. Tres sustituciones de la base, G / C, G / T y C / T, pueden ocurrir como resultado del daño oxidativo por los iones metálicos, como Fe21, Cu21 y Ni21. Reid et al65 demostraron que el G / C fue producido predominantemente por Fe21 mientras que la sustitución C / T fue por Cu21 y Ni21.
ANTIOXIDANTES
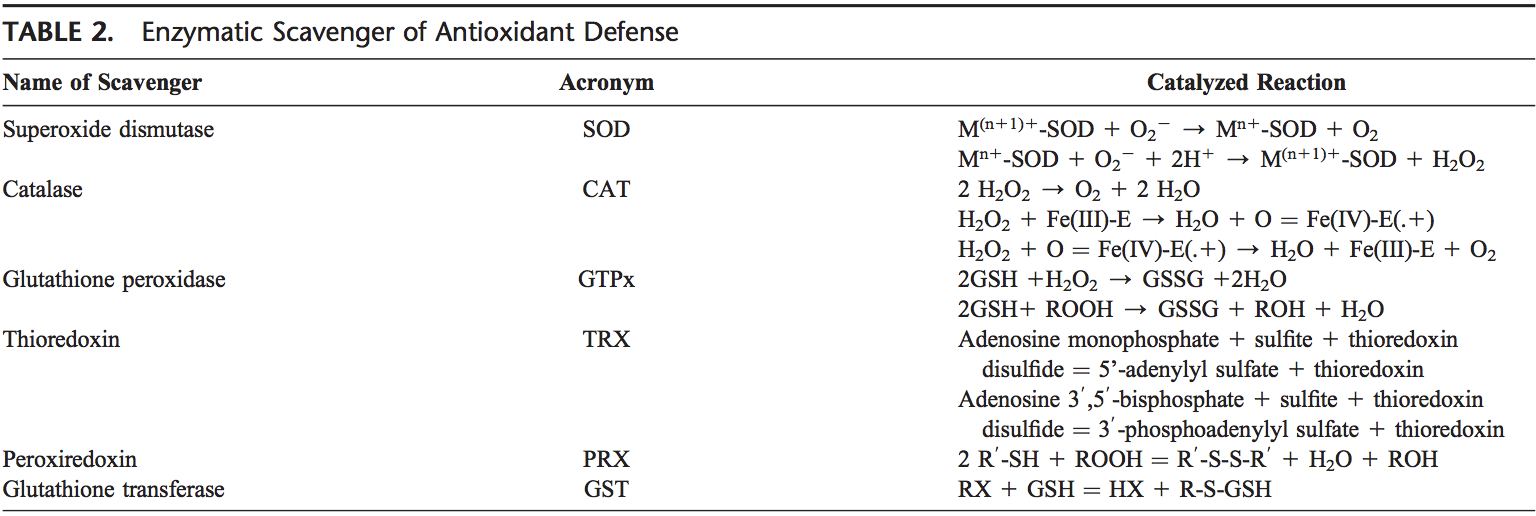
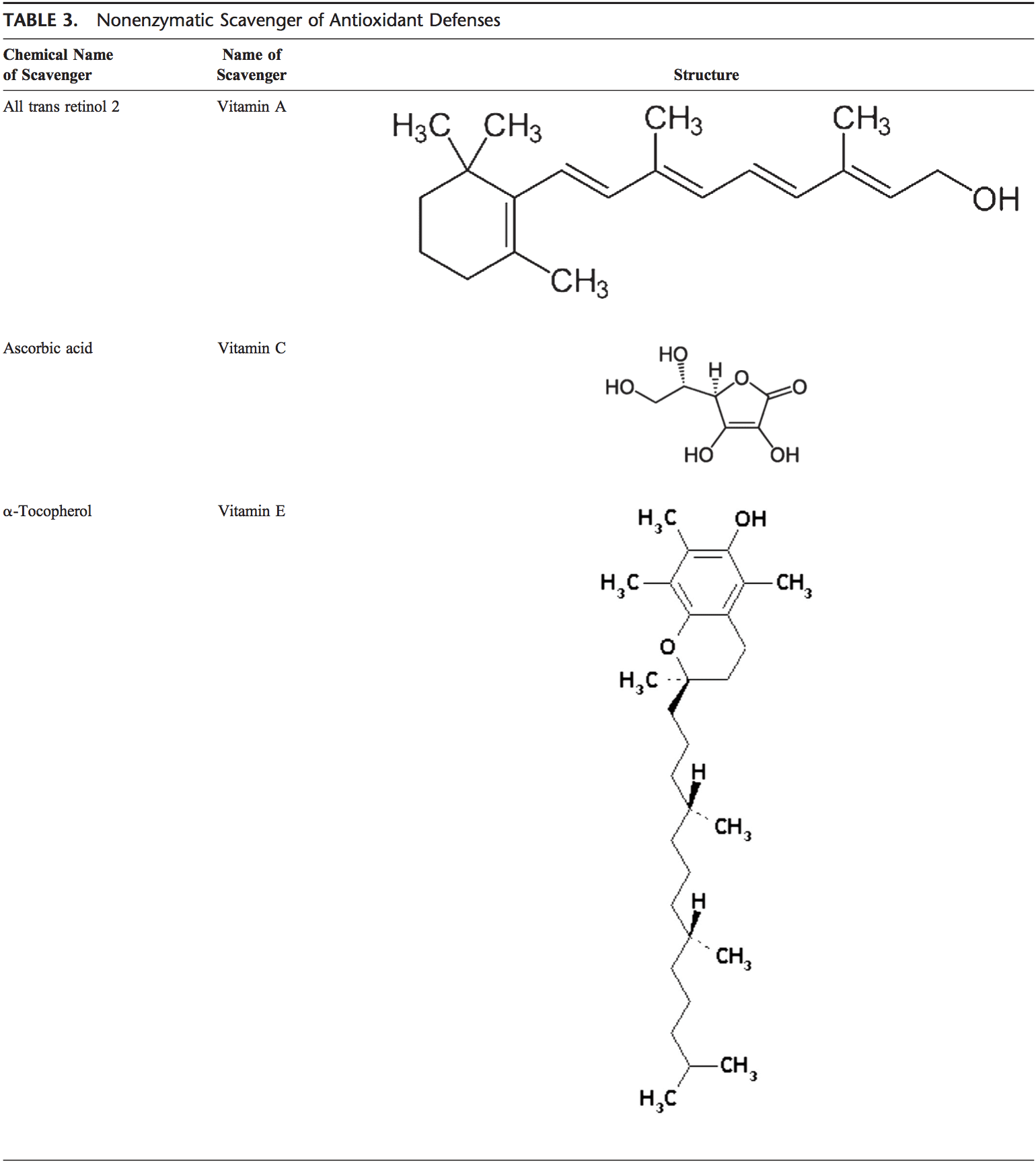
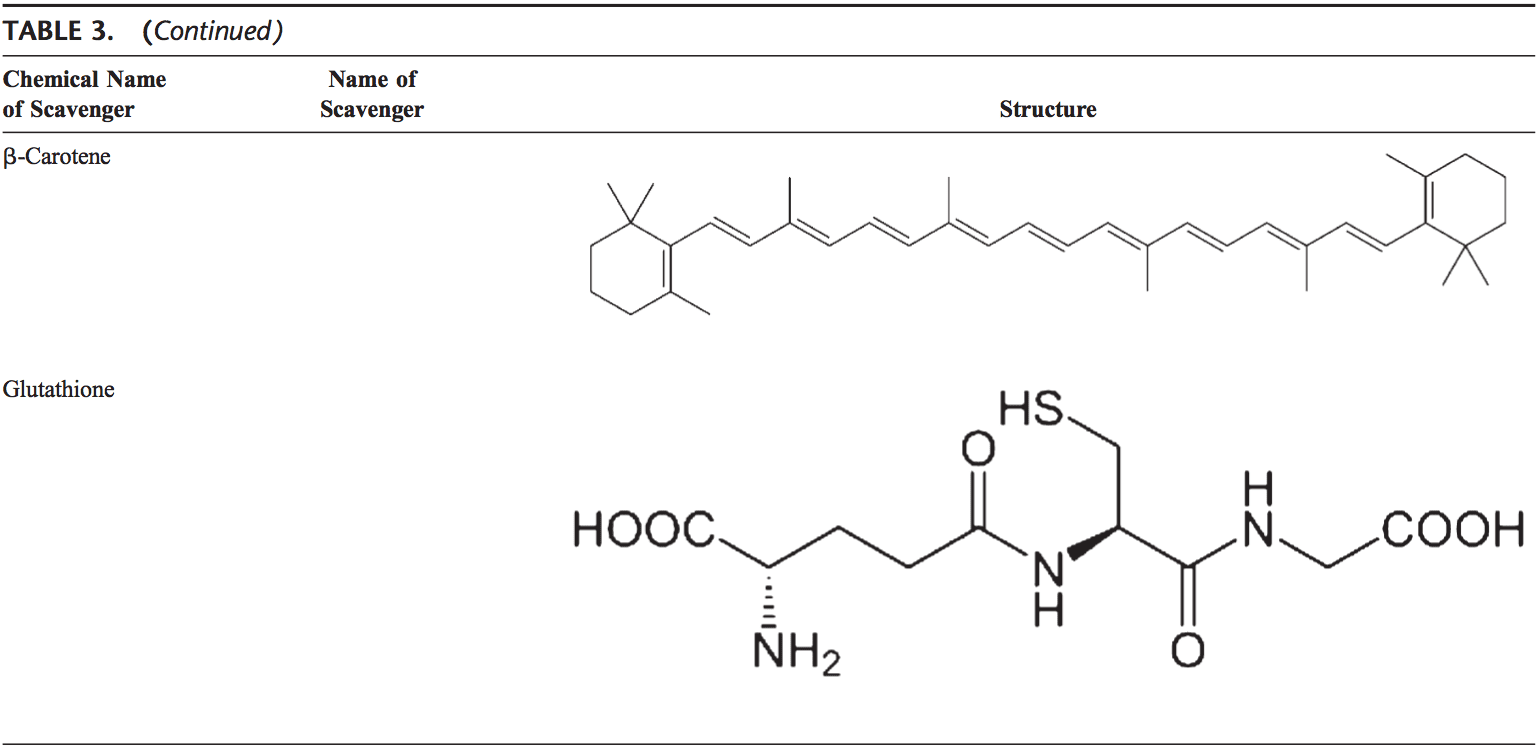
El cuerpo humano está equipado con una variedad de antioxidantes que sirven para contrarrestar el efecto de los oxidantes. Para todos los propósitos prácticos, estos pueden ser divididos en categorías 2: enzimática (Tabla 2) y no enzimática (Tabla 3).
 Antioxidantes Enzimáticos
Antioxidantes Enzimáticos
Los principales antioxidantes enzimáticos de los pulmones son SOD (EC 1.15.1.11), catalasa (EC 1.11.1.6) y GSH-Px (EC 1.11.1.9). Además de estas enzimas principales, se han encontrado también otros antioxidantes, incluyendo la oximexina-1 (EC 1.14.99.3) y las proteínas redox, tales como tiorredoxinas (TRXs, EC 1.8.4.10), peroxiredoxinas (PRXs, EC 1.11.1.15) y glutaredoxinas juegan un papel crucial en las defensas antioxidantes pulmonares.
Dado que el superóxido es el ROS primario producido a partir de una variedad de fuentes, su dismutación por SOD es de importancia primordial para cada célula. Todas las formas 3 de SOD, es decir, CuZn-SOD, Mn-SOD y EC-SOD, se expresan ampliamente en el pulmón humano. Mn-SOD se localiza en la matriz mitocondrial. EC-SOD se localiza principalmente en la matriz extracelular, especialmente en áreas que contienen altas cantidades de fibras de colágeno tipo I y alrededor de vasos pulmonares y sistémicos. También se ha detectado en el epitelio bronquial, el epitelio alveolar y los macrófagos alveolares. 66,67 En general, se piensa que CuZn-SOD y Mn-SOD actúan como depuradores a granel de radicales superóxido. El nivel EC-SOD relativamente alto en el pulmón con su unión específica a los componentes de la matriz extracelular puede representar un componente fundamental de la protección de la matriz pulmonar. 68
H2O2 que se produce por la acción de SODs o la acción de oxidasas, como la xantina oxidasa, se reduce a agua por la catalasa y el GSH-Px. La catalasa existe como un tetramero compuesto de monómeros idénticos 4, cada uno de los cuales contiene un grupo heme en el sitio activo. La degradación de H2O2 se realiza mediante la conversión entre las conformaciones 2 de catalasa-ferricatalasa (hierro coordinado al agua) y compuesto I (hierro complejado con un átomo de oxígeno). La catalasa también se une al NADPH como un equivalente reductor para evitar la inactivación oxidativa de la enzima (formación del compuesto II) por H2O2 a medida que se reduce a agua.69
Las enzimas del ciclo redox responsables de la reducción de H2O2 y de los hidroperóxidos lipídicos (generados como resultado de la peroxidación lipídica de la membrana) incluyen el GSH-Pxs.70 Los GSH-Px son una familia de enzimas tetraméricas que contienen la única selenocisteína de aminoácidos dentro del activos y utilizan tioles de bajo peso molecular, tales como GSH, para reducir H2O2 y peróxidos lipídicos a sus correspondientes alcoholes. Se han descrito cuatro GSH-Pxs, codificados por diferentes genes: GSH-Px-1 (GSH-Px celular) es omnipresente y reduce H2O2 y peróxidos de ácidos grasos, pero no los peroxil-lípidos esterificados.71 Los lípidos esterificados se reducen por GSH -Px-4 (hidroperóxido de fosfolípido GSH-Px), que puede utilizar varios tioles de bajo peso molecular como equivalentes reductores. GSH-Px-2 (GSH-Px extracelular) es el único miembro de la familia de GSH-Px que reside en las células epiteliales gastrointestinales. el compartimento extracelular y se cree que es una de las enzimas antioxidantes extracelulares más importantes en los mamíferos. De estos, GSH-Px extracelular es el más ampliamente investigado en el pulmón humano.72
Además, la eliminación de H2O2 está estrechamente asociada con varias enzimas que contienen tiol, a saber, las TRX (TRX1 y TRX2), las reductasas de la tiorredoxina (EC1.8.1.9) (TRRs), PRXs (que son peroxidasas de la tiorredoxina) y las glutaredoxinas.74
Dos TRXs y TRRs se han caracterizado en células humanas, existentes en citosol y mitocondrias. En el pulmón, TRX y TRR se expresan en epitelio bronquial y alveolar y macrófagos. Seis diferentes PRXs se han encontrado en las células humanas, que difieren en su compartimentación ultraestructural. Estudios experimentales han revelado la importancia de PRX VI en la protección del epitelio alveolar. El pulmón humano expresa todas las PRXs en el epitelio bronquial, el epitelio alveolar y los macrófagos. 75 PRX V recientemente se ha encontrado que funciona como una peroxinitrito reductasa, 76, lo que significa que puede funcionar como un potencial compuesto protector en el desarrollo de ROS mediada por lesión pulmonar .77
Común a estos antioxidantes es el requisito de NADPH como un equivalente reductor. NADPH mantiene la catalasa en forma activa y se utiliza como cofactor por TRX y GSH reductasa (EC 1.6.4.2), que convierte GSSG a GSH, un co-sustrato para el GSH-Pxs. El NADPH intracelular, a su vez, se genera por la reducción de NADP1 por la glucosa-6-fosfato deshidrogenasa, la primera enzima y limitante de la velocidad de la vía de pen- tosa fosfato, durante la conversión de fosfato de glucosa-6 a 6-fosfogluconolactona. Mediante la generación de NADPH, la glucosa-6-fosfato deshidrogenasa es un determinante crítico de la capacidad de amortiguación GSH citosólica (GSH / GSSG) y, por lo tanto, puede considerarse una enzima antioxidante reguladora esencial.78,79
Las GST (EC 2.5.1.18), otra familia de enzimas antioxidantes, inactivan metabolitos secundarios, como aldehídos insaturados, epóxidos e hidroperóxidos. Se han descrito tres familias principales de GST: GST citosólica, GST mitocondrial,80,81 y GST microsomal asociada a la membrana que tiene un papel en el metabolismo de eicosanoides y GSH.82 Se identifican siete clases de GST citosólica en mamíferos, denominadas Alfa, Mu, Pi, Sigma, Theta, Omega y Zeta.83–86 Durante condiciones sin estrés, las GST de clase Mu y Pi interactúan con las quinasas Ask1 y JNK, respectivamente, e inhiben estas quinasas.87–89 Se ha demostrado que GSTP1 se disocia de JNK en respuesta al estrés oxidativo.89 GSTP1 también interactúa físicamente con PRX VI y conduce a la recuperación de la actividad de la enzima PRX a través de la glutatión de la proteína oxidada.90
Antioxidantes no enzimáticos
Los antioxidantes no enzimáticos incluyen compuestos de bajo peso molecular, tales como vitaminas (vitaminas C y E), b-caroteno, ácido úrico y GSH, un tripéptido (Lg-glutamil-L-cisteinil-L-glicina) que comprende un tiol sulfhidrilo).
Vitamina C (ácido ascórbico)
La vitamina C soluble en agua (ácido ascórbico) proporciona capacidad antioxidante intracelular y extracelular de fase acuosa principalmente mediante la eliminación de radicales libres de oxígeno. Convierte los radicales libres de vitamina E en vitamina E. Se ha demostrado que sus niveles plasmáticos disminuyen con la edad. 91,92
Vitamina E (a-tocoferol)
La vitamina E soluble en lípidos se concentra en el sitio interior hidrofóbico de la membrana celular y es la principal defensa contra la lesión de la membrana inducida por el oxidante. La vitamina E dona electrones al radical peroxilo, que se produce durante la peroxidación de lípidos. El tocoferol es la forma más activa de la vitamina E y el principal antioxidante ligado a la membrana celular. La vitamina E desencadena la apoptosis de las células cancerosas e inhibe las formaciones de radicales libres.93
El glutatión
GSH es muy abundante en todos los compartimentos celulares y es el principal antioxidante soluble. GSH / GSSG es un factor determinante del estrés oxidativo. GSH muestra sus efectos antioxidantes de varias maneras.94 Desintoxica peróxido de hidrógeno y peróxidos lipídicos por acción de GSH-Px. GSH dona su electrón a H2O2 para reducirlo a H2O y O2. GSSG se reduce de nuevo en GSH por GSH reductasa que utiliza NAD (P) H como el donante de electrones. Los GSH-Px también son importantes para la protección de la membrana celular a partir de la peroxidación lipídica. El glutatión reducido dona protones a los lípidos de la membrana y los protege de los ataques de oxidantes. 95
GSH es un cofactor para varias enzimas desintoxicantes, tales como GSH-Px y transferasa. Tiene un papel en la conversión de la vitamina C y E de nuevo a sus formas activas. GSH protege las células contra la apoptosis mediante la interacción con vías de señalización proapoptóticas y antiapoptóticas. 94 También regula y activa varios factores de transcripción, como AP-1, NF-kB y Sp-1.
Carotenoides (b-caroteno)
Los carotenoides son pigmentos que se encuentran en las plantas. Principalmente, se ha encontrado que el b-caroteno reacciona con los radicales peroxilo (ROO), hidroxilo (OH) y superóxido (O22). 96 Los carotenoides muestran sus efectos antioxidantes en la baja presión parcial de oxígeno, pero pueden tener efectos prooxidantes en oxígeno superior concentraciones.97 Tanto los carotenoides como los ácidos retinoicos (RA) son capaces de regular factores de transcripción. 98 b-Caroteno inhibe la activación de NF-kB inducida por oxidante y la producción de interleucina (IL) -6 y factor de necrosis tumoral-a. Los carotenoides también afectan la apoptosis de las células. Los efectos antiproliferativos de la AR se han demostrado en varios estudios. Este efecto de la AR está mediado principalmente por receptores de ácido retinoico y varía entre los tipos de células. En las células de carcinoma mamario, se demostró que el receptor del ácido retinoico desencadenaba la inhibición del crecimiento induciendo el paro del ciclo celular, la apoptosis o ambos. 99,100
EL EFECTO DEL ESTRÉS OXIDATIVO: MECANISMOS GENÉTICOS, FISIOLÓGICOS Y BIOQUÍMICOS
El estrés oxidativo se produce cuando el equilibrio entre los antioxidantes y ROS se interrumpen debido a la depleción de antioxidantes o la acumulación de ROS. Cuando se produce un estrés oxidativo, las células intentan contrarrestar los efectos oxidantes y restaurar el equilibrio redox mediante la activación o el silenciamiento de genes que codifican enzimas defensivas, factores de transcripción y proteínas estructurales.101,102 La proporción entre glutatión oxidado y reducido (2GSH / GSSG) es una de los determinantes importantes del estrés oxidativo en el cuerpo. Una mayor producción de ROS en el cuerpo puede cambiar la estructura del ADN, resultar en la modificación de proteínas y lípidos, la activación de varios factores de transcripción inducida por el estrés, y la producción de pro-inflamatorios y anti-inflamatorios citoquinas.
Efectos del estrés oxidativo sobre el ADN
ROS puede conducir a modificaciones de ADN de varias maneras, lo que implica la degradación de bases, rupturas de DNA de una o dos cadenas, modificaciones, mutaciones, deleciones o translocaciones de purina, pirimidina o azúcar, y reticulación con proteínas. La mayoría de estas modificaciones del ADN (Fig. 1) son altamente relevantes para la carcinogénesis, el envejecimiento y las enfermedades neurodegenerativas, cardiovasculares y autoinmunes. El humo del tabaco, los metales redox y los metales no redox, como el hierro, el cadmio, el cromo y el arsénico, también están implicados en la carcinogénesis y el envejecimiento al generar radicales libres o unirse a grupos tiol. La formación de 8-OH-G es el daño ADN más conocido que se produce a través del estrés oxidativo y es un biomarcador potencial para la carcinogénesis.
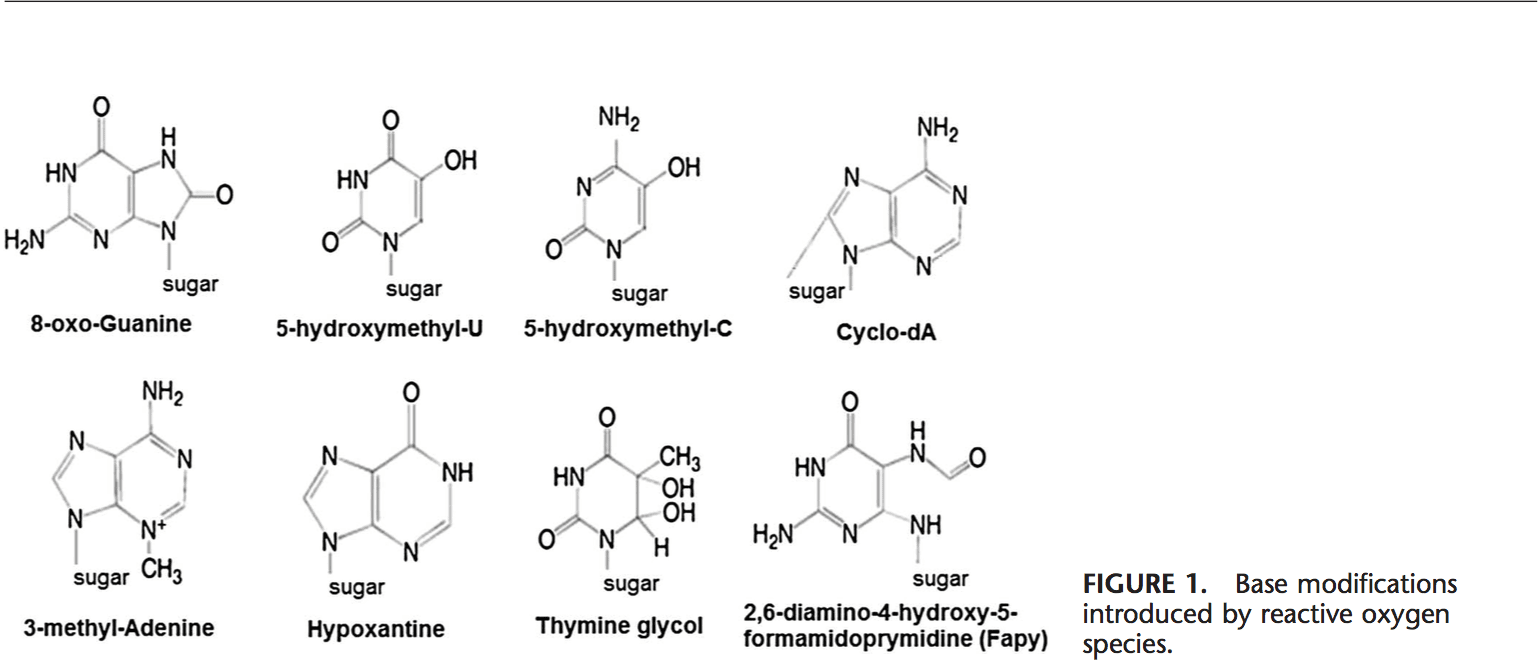 Las regiones promotoras de genes contienen secuencias de consenso para factores de transcripción. Estos sitios de unión a factores de transcripción contienen secuencias ricas en GC que son susceptibles a ataques oxidantes. La formación de ADN 8-OH-G en los sitios de unión del factor de transcripción puede modificar la unión de los factores de transcripción y, por lo tanto, cambiar la expresión de genes relacionados, como se ha demostrado para las secuencias objetivo de AP-1 y Sp-1 Además de 103-OH-G, También se ha demostrado que la 8-ciclo-8,59-desoxiadenosina (ciclo-dA) inhibe la transcripción de un gen informador en un sistema celular si se encuentra en una caja TATA.29 La proteína de unión a TATA inicia la transcripción cambiando la flexión del ADN . La unión de la proteína de unión a TATA puede verse afectada por la presencia de ciclo-dA.
Las regiones promotoras de genes contienen secuencias de consenso para factores de transcripción. Estos sitios de unión a factores de transcripción contienen secuencias ricas en GC que son susceptibles a ataques oxidantes. La formación de ADN 8-OH-G en los sitios de unión del factor de transcripción puede modificar la unión de los factores de transcripción y, por lo tanto, cambiar la expresión de genes relacionados, como se ha demostrado para las secuencias objetivo de AP-1 y Sp-1 Además de 103-OH-G, También se ha demostrado que la 8-ciclo-8,59-desoxiadenosina (ciclo-dA) inhibe la transcripción de un gen informador en un sistema celular si se encuentra en una caja TATA.29 La proteína de unión a TATA inicia la transcripción cambiando la flexión del ADN . La unión de la proteína de unión a TATA puede verse afectada por la presencia de ciclo-dA.
El estrés oxidativo causa la inestabilidad de las regiones de microsatélites (repeticiones en tándem corto). Los iones de metal reactivos redox, los radicales hidroxilo aumentan la inestabilidad de los microsatélites. 105 Aunque las rupturas de ADN monocatenario causadas por lesiones oxidantes pueden ser fácilmente toleradas por las células, las rupturas de ADN bicatenario inducidas por radiación ionizante pueden ser una amenaza significativa para la supervivencia celular.
La metilación en las islas CpG en el ADN es un importante mecanismo epigenético que puede resultar en el silenciamiento de genes. Oxidación de 5-MeCyt a 5-hidroximetil uracilo (5-OHMeUra) puede ocurrir a través de reacciones de desaminación / oxidación de timina o 5-hidroximetil citosina intermedios.107 Además de la modulación de la expresión génica, la metilación del ADN también parece afectar la cromatina organization.108 Los patrones aberrantes de metilación del ADN inducidos por ataques oxidativos también afectan la actividad de reparación del ADN.
Efectos del estrés oxidativo sobre los lípidos
Las ERO pueden inducir la peroxidación de lípidos y alterar la disposición de la bicapa lipídica de la membrana que puede inactivar los receptores y las enzimas unidos a la membrana y aumentar la permeabilidad de los tejidos. -enlaces.109–110 El 112-hidroxi-4-nonenal provoca el agotamiento del GSH intracelular e induce la producción de peróxido,2 activa el receptor del factor de crecimiento epidérmico,113,114 e induce la producción de fibronectina.115 Los productos de peroxidación lipídica, como los isoprostanos y el ácido tiobarbitúrico reactivo sustancias, se han utilizado como biomarcadores indirectos de estrés oxidativo, y se mostraron niveles aumentados en el condensado del aliento exhalado o líquido de lavado broncoalveolar o pulmón de pacientes con enfermedad pulmonar obstructiva crónica o fumadores.116-117
Efectos del estrés oxidativo sobre las proteínas
Las ERO pueden provocar la fragmentación de la cadena peptídica, la alteración de la carga eléctrica de las proteínas, el entrecruzamiento de las proteínas y la oxidación de aminoácidos específicos y, por lo tanto, aumentar la susceptibilidad a la proteólisis por degradación por proteasas específicas.120 Los residuos de cisteína y metionina en las proteínas son particularmente más susceptibles a la oxidación.121 La oxidación de los grupos sulfhidrilo o los residuos de metionina de las proteínas causan cambios conformacionales, desdoblamiento de proteínas y degradación.8,121–123 Las enzimas que tienen metales en sus sitios activos o cerca de ellos son especialmente más sensibles a la oxidación catalizada por metales. . Se ha demostrado que la modificación oxidativa de las enzimas inhibe sus actividades.124,125
En algunos casos, puede tener lugar la oxidación específica de las proteínas. Por ejemplo, la metionina puede ser sulfóxido de metionina oxidado 126 y fenilalanina a o-tirosina 127; los grupos sulfhidrilo se pueden oxidar para formar enlaces disulfuro, 128 y grupos carbonilo pueden introducirse en las cadenas laterales de proteínas. Los rayos gamma, la oxidación catalizada por metales, el HOCl y el ozono pueden causar la formación de grupos carbonilo.129
Efectos del estrés oxidativo sobre la transducción de señales
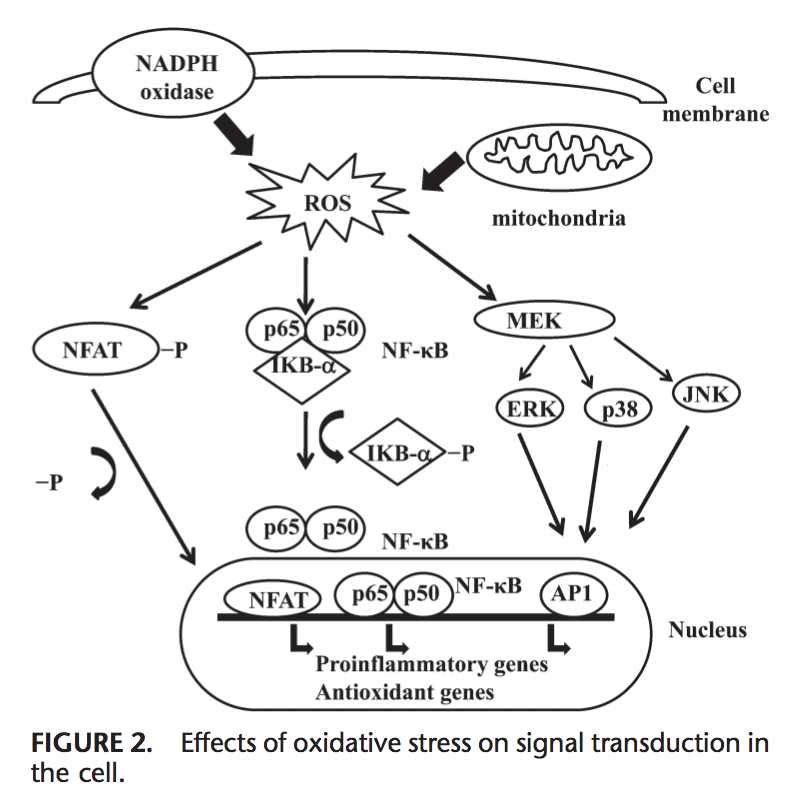
Las ROS pueden inducir la expresión de varios genes involucrados en la transducción de señales.1,130 Una relación alta de GSH/GSSG es importante para la protección de la célula contra el daño oxidativo. La interrupción de esta relación provoca la activación de factores de transcripción sensibles a redox, como NF-kB, AP-1, factor nuclear de células T activadas y factor 1 inducible por hipoxia, que están involucrados en la respuesta inflamatoria. La activación de los factores de transcripción a través de ROS se logra mediante cascadas de transducción de señales que transmiten la información desde el exterior hacia el interior de la célula. Los receptores de tirosina cinasa, la mayoría de los receptores del factor de crecimiento, como el receptor del factor de crecimiento epidérmico, el receptor del factor de crecimiento endotelial vascular y el receptor del factor de crecimiento derivado de plaquetas, las proteínas tirosina fosfatasas y las serina/treonina cinasas son objetivos de las ERO.131– 133 Las quinasas reguladas por señales extracelulares, JNK y p38, que son miembros de la familia de proteínas quinasas activadas por mitógenos y están involucradas en varios procesos celulares, incluida la proliferación, diferenciación y apoptosis, también pueden ser reguladas por oxidantes.
En condiciones de estrés oxidativo, los residuos de cisteína en el sitio de unión al ADN de c-Jun, algunas subunidades de AP-1 y la kB quinasa inhibidora sufren S-glutatiolación reversible. Se ha informado que la glutaredoxina y la TRX desempeñan un papel importante en la regulación de las vías de señalización sensibles a redox, como NF-kB y AP-1, la proteína quinasa activada por mitógeno p38 y JNK.134–137
NF-kB puede activarse en respuesta a condiciones de estrés oxidativo, como ROS, radicales libres e irradiación UV.138 La fosforilación de IkB libera NF-kB y le permite ingresar al núcleo para activar la transcripción génica.139 Varias quinasas han se ha informado que fosforila IkB en los residuos de serina. Estas quinasas son los objetivos de las señales oxidativas para la activación de NF-kB.140 Los agentes reductores mejoran la unión al ADN de NF-kB, mientras que los agentes oxidantes inhiben la unión de NF-kB al ADN. TRX puede ejercer 2 acciones opuestas en la regulación de NF-kB: en el citoplasma, bloquea la degradación de IkB e inhibe la activación de NF-kB pero mejora la unión al ADN de NF-kB en el núcleo.141 Activación de NF-kB a través de la degradación relacionada con la oxidación de IkB da como resultado la activación de varios genes relacionados con la defensa antioxidante. NF-kB regula la expresión de varios genes que participan en la respuesta inmune, como IL-1b, IL-6, factor de necrosis tumoral-a, IL-8 y varias moléculas de adhesión.142,143 NF-kB también regula la angiogénesis y la proliferación y diferenciación de células.
AP-1 también está regulado por el estado redox. En presencia de H2O2, algunos iones metálicos pueden inducir la activación de AP-1. El aumento de la relación de GSH / GSSG mejora la unión de AP-1 mientras que GSSG inhibe la unión de ADN de AP-1.144 La unión de ADN del heterodímero Fos / Jun se incrementa mediante la reducción de una única cisteína conservada en el dominio de unión a ADN de cada uno de las proteínas, 145 mientras que el ADN vinculante de AP-1 puede ser inhibido por GSSG en muchos tipos de células, lo que sugiere que la formación de enlaces disulfuro de residuos de cisteína inhibe AP-1 ADN binding.146,147 Transducción de señal a través de estrés oxidativo se resume en la Figura 2.
CONCLUSIONES
El estrés oxidativo puede surgir de la sobreproducción de ROS por las reacciones metabólicas que utilizan el oxígeno y cambiar el equilibrio entre oxidanteantioxidante estatus a favor de los oxidantes. Los ROS son producidos por actividades metabólicas celulares y factores ambientales, como los contaminantes del aire o el humo del cigarrillo. Los ROS son moléculas altamente reactivas debido a electrones no emparejados en su estructura y reaccionan con varias macromoléculas biológicas en la célula, tales como carbohidratos, ácidos nucleicos, lípidos y proteínas, y alteran sus funciones. ROS también afecta a la expresión de varios genes por upregulation de redox sensibles factores de transcripción y remodelación de la cromatina a través de la alteración en la acetilación / desacetilación de las histonas. La regulación del estado redox es crítica para la viabilidad celular, activación, proliferación y función de órganos.
Referencias
- Valko M, Rhodes CJ, Moncol J, Izakovic M, Mazur M. Radicales libres, metales y antioxidantes en el cáncer inducido por estrés oxidativo. Chem Biol Interact. 2006;160:1-40.
- Halliwell B, Gutteridge JMC. Radicales libres en biología y medicina. 3rd ed. Nueva York: Oxford University Press; 1999.
- Marnet LJ. Peroxidación lipídica y daño al ADN por malondialdehído. Mutat Res. 1999;424:83–95.
- Siems WG, Grune T, Esterbauer H. Formación de 4-hidroxinonenal durante la isquemia y reperfusión del intestino delgado de rata. Ciencias de la vida. 1995;57:785–789.
- Urgencias Stadtman. Papel de las especies oxidantes en el envejecimiento. Curr Med Chem. 2004;11:1105–1112.
- Wang MY, Dhingra K, Hittelman WN, Liehr JG, deAndrade M, Li DH. Aductos putativos de malondialdehído-ADN inducidos por peroxidación lipídica en tejidos mamarios humanos. Biomarcadores de Epidemiol de Cáncer Prev. 1996;5:705–710.
- Jenner P. Estrés oxidativo en la enfermedad de Parkinson. Ana Neurol. 2003;53: T26-T36.
- Lyras L, Cairns NJ, Jenner A, Jenner P, Halliwell B. Evaluación del daño oxidativo de proteínas, lípidos y ADN en el cerebro de pacientes con enfermedad de Alzheimer. J Neurochem. 1997;68:2061-2069.
- Sayre LM, Smith MA, Perry G. Química y bioquímica del estrés oxidativo en enfermedades neurodegenerativas. Curr Med Chem. 2001;8:721–738.
- Toshniwal PK, Zarling EJ. Evidencia de aumento de la peroxidación de lípidos en la esclerosis múltiple. Res. neuroquímica. 1992; 17:205–207.
- Dhalla NS, Temsah RM, Netticadan T. Papel del estrés oxidativo en las enfermedades cardiovasculares. J hipertensos. 2000;18:655–673.
- Kasparova S, Brezova V, Valko M, Horecky J, Mlynarik V, et al. Estudio del estrés oxidativo en un modelo de rata con hipoperfusión cerebral crónica. Neuroquímica Int. 2005;46:601-611.
- Kerr S, Brosnan MJ, McIntyre M, Reid JL, Dominiczak AF, Hamilton CA. La producción de anión superóxido aumenta en un modelo de hipertensión genética: papel del endotelio. Hipertensión. 1999;33:1353–1358.
- Kukreja RC, Hess ML. El sistema de radicales libres de oxígeno: desde ecuaciones a través de interacciones membrana-proteína hasta lesión y protección cardiovascular. Cardiovascular Res. 1992; 26:641-655.
- Asami S, Manabe H, Miyake J, Tsurudome Y, Hirano T, et al. Fumar cigarrillos induce un aumento en el daño oxidativo del ADN, 8-hidroxideoxiguanosina, en un sitio central del pulmón humano. Carcinogénesis. 1997;18:1763-1766.
- Andreadis AA, Hazen SL, Comhair SA, Erzurum SC. Eventos oxidativos y nitrosativos en el asma. Radic Libre Biol Med. 2003;35:213–225.
- Comhair SA, Ricci KS, Arroliga M, Lara AR, Dweik RA, et al. Correlación de la deficiencia sistémica de superóxido dismutasa con la obstrucción del flujo de aire en el asma. Am J Respir Crit Care Med. 2005;172:306-313.
- Comhair SA, Xu W, Ghosh S, Thunnissen FB, Almasan A, et al. Inactivación de la superóxido dismutasa en la fisiopatología de la remodelación y reactividad de las vías respiratorias asmáticas. Soy J Pathol. 2005;166:663–674.
-
Dut R, Dizdar EA, Birben E, Sackesen C, Soyer OU, Besler T, Kalayci O. Estrés oxidativo y sus determinantes en las vías respiratorias de niños con asma. Alergia. 2008;63:1605–1609.
-
Ercan H, Birben E, Dizdar EA, Keskin O, Karaaslan C, et al. Estrés oxidativo y determinantes genéticos y epidemiológicos de la lesión oxidante en el asma infantil. J Allergy Clin Immunol. 2006;118:1097–1104.
- Fitzpatrick AM, Teague WG, Holguín F, Yeh M, Brown LA. Programa de Investigación del Asma Severa. La homeostasis del glutatión en las vías respiratorias se altera en niños con asma grave: evidencia de estrés oxidativo. J Allergy Clin Immunol. 2009;123:146–152.
- Miller DM, Buettner GR, Aust SD. Metales de transición como catalizadores de reacciones de “autooxidación”. Radic Libre Biol Med. 1990; 8:95–108.
- Dupuy C, Virion A, Ohayon R, Kaniewski J, Dème D, Pommier J. Mecanismo de formación de peróxido de hidrógeno catalizada por NADPH oxidasa en la membrana plasmática de la tiroides. J Biol Chem. 1991;266:3739-3743.
- Granger DN. Papel de la xantina oxidasa y los granulocitos en la lesión por isquemia-reperfusión. Soy J Physiol. 1988;255:H1269–H1275.
- Fenton HJH. Oxidación del ácido tartárico en presencia de hierro. J Chem Soc. 1984;65:899–910.
- Haber F, Weiss JJ. La descomposición catalítica del peróxido de hidrógeno por sales de hierro. Proc R Soc Lond Ser A. 1934;147:332–351.
- Liochev SI, Fridovich I. El ciclo de Haber-Weiss 70 años después: una visión alternativa. Redox Rep. 2002;7:55–57.
- Klebanoff SJ. Mieloperoxidasa: amigo y enemigo. J Leukoc Biol. 2005;77:598–625.
- Whiteman M, Jenner A, Halliwell B. Modificaciones de base inducidas por ácido hipocloroso en ADN aislado de timo de ternera. Chem Res Toxicol. 1997;10:1240-1246.
- Kulcharyk PA, Heinecke JW. El ácido hipocloroso producido por el sistema mieloperoxidasa de los fagocitos humanos induce enlaces cruzados covalentes entre el ADN y la proteína. Bioquímica. 2001;40:3648–3656.
- Brennan ML, Wu W, Fu X, Shen Z, Song W, et al. Una historia de dos controversias: definir tanto el papel de las peroxidasas en la formación de nitrotirosina in vivo utilizando ratones deficientes en eosinófilos peroxidasa y mieloperoxidasa, y la naturaleza de las especies de nitrógeno reactivo generadas por peroxidasa. J Biol Chem. 2002;277:17415–17427.
- Denzler KL, Borchers MT, Crosby JR, Cieslewicz G, Hines EM, et al. La desgranulación extensa de eosinófilos y la oxidación mediada por peroxidasa de las proteínas de las vías respiratorias no ocurren en un modelo de inflamación pulmonar de exposición a ovoalbúmina en ratones. J Immunol. 2001;167:1672–1682.
- van Dalen CJ, Winterbourn CC, Senthilmohan R, Kettle AJ. El nitrito como sustrato e inhibidor de la mieloperoxidasa. Implicaciones para la nitración y la producción de ácido hipocloroso en sitios de inflamación. J Biol Chem. 2000;275:11638–11644.
- Madera LG, Fitzgerald DA, Gibson PG, Cooper DM, Garg ML. La peroxidación lipídica determinada por los isoprostanos plasmáticos está relacionada con la gravedad de la enfermedad en el asma leve. lípidos. 2000;35:967–974.
- Montuschi P, Corradi M, Ciabattoni G, Nightingale J, Kharitonov SA, Barnes PJ. Aumento de 8-isoprostano, un marcador de estrés oxidativo, en el condensado exhalado de pacientes con asma. Am J Respir Crit Care Med. 1999;160:216–220.
- Iglesia DF, Pryor WA. Química de radicales libres del humo del cigarrillo y sus implicaciones toxicológicas. Perspectiva de salud ambiental. 1985;64:111-126.
- Hiltermann JT, Lapperre TS, van Bree L, Steerenberg PA, Brahim JJ, et al. Inflamación inducida por ozono evaluada en esputo y líquido de lavado bronquial de asmáticos: una nueva herramienta no invasiva en estudios epidemiológicos sobre la contaminación del aire y el asma. Radic Libre Biol Med. 1999;27:1448-1454.
- Nightingale JA, Rogers DF, Barnes PJ. Efecto del ozono inhalado sobre el óxido nítrico exhalado, la función pulmonar y el esputo inducido en sujetos normales y asmáticos. Tórax. 1999;54:1061-1069.
- Cho AK, Sioutas C, Miguel AH, Kumagai Y, Schmitz DA, et al. Actividad redox de partículas suspendidas en el aire en diferentes sitios de la cuenca de Los Ángeles. Res. Medio Ambiente. 2005;99:40–47.
- Comhair SA, Thomassen MJ, Erzurum SC. Inducción diferencial de glutatión peroxidasa extracelular y óxido nítrico sintasa 2 en las vías respiratorias de individuos sanos expuestos al 100% de O(2) o humo de cigarrillo. Am J Respir Cell Mol Biol. 2000; 23:350–354.
- Matthay MA, Geiser T, Matalon S, Ischiropoulos H. Lesión pulmonar mediada por oxidantes en el síndrome de dificultad respiratoria aguda. Crit Care Med. 1999;27:2028-2030.
- Biaglow JE, Mitchell JB, Held K. La importancia del peróxido y el superóxido en la respuesta de rayos X. Int J Radiat Oncol Biol Phys. 1992; 22:665–669.
- Chiu SM, Xue LY, Friedman LR, Oleinick NL. Sensibilización mediada por iones de cobre de los sitios de unión de la matriz nuclear a la radiación ionizante. Bioquímica. 1993;32:6214–6219.
- Narayanan PK, Goodwin EH, Lehnert BE. Las partículas alfa inician la producción biológica de aniones superóxido y peróxido de hidrógeno en las células humanas. Cáncer Res. 1997;57:3963–3971.
- Tuttle SW, Varnes ME, Mitchell JB, Biaglow JE. Sensibilidad a oxidantes químicos y radiación en líneas celulares CHO deficientes en la actividad del ciclo oxidativo de las pentosas. Int J Radiat Oncol Biol Phys. 1992;22: 671–675.
- Guo G, Yan-Sanders Y, Lyn-Cook BD, Wang T, Tamae D, y col. Manganeso
superóxido dismutasa mediada por la expresión génica en radiación inducida por
respuestas adaptativas. Mol Cell Biol. 2003;23:2362–2378. - Azzam EI, de Toledo SM, Spitz DR, Little JB. Metabolismo oxidativo
modula la transducción de señales y la formación de micronúcleos en espectadores
células de fibroblastos humanos normales irradiados con una partícula. Cancer Res.
2002;62:5436–5442. - Leach JK, Van Tuyle G, Lin PS, Schmidt-Ullrich R, Mikkelsen RB.
Generación ionizante inducida por radiación, mitocondria-dependiente de reactivo
oxígeno/nitrógeno. Cáncer Res. 2001;61:3894–3901. - Dent P, Yacoub A, Fisher PB, Hagan MP, Grant S. MAPK vías en
respuestas a la radiación. Oncogén. 2003;22:5885–5896. - Wei SJ, Botero A, Hirota K, CM Bradbury, Markovina S, y col. Thioredoxin
La translocación nuclear y la interacción con el factor redox-1 activa el factor de transcripción AP-1 en respuesta a la radiación ionizante. Cáncer Res. 2000;60:6688–6695. - Cadet J, Douki T, Gasparutto D, Ravanat JL. Daño oxidativo al ADN: formación, medida y características bioquímicas. Mutat Res. 2003; 531:5-23.
- Yokoya A, Cunniffe SM, O'Neill P. Efecto de la hidratación en la inducción de roturas de hebras y lesiones de base en películas de ADN plasmídico por radiación gamma. J Am Chem Soc. 2002;124:8859–8866.
- Janssen YM, Van Houten B, Borm PJ, Mossman BT. Respuestas celulares y tisulares al daño oxidativo. Inversión de laboratorio. 1993;69:261-274.
- Iwanaga M, Mori K, Iida T, Urata Y, Matsuo T, et al. Inducción dependiente del factor nuclear kappa B de gamma glutamilcisteína sintetasa mediante radiación ionizante en células de glioblastoma humano T98G. Radic Libre Biol Med. 1998;24:1256–1268.
- Stohs SJ, Bagchi D. Mecanismos oxidativos en la toxicidad de los iones metálicos. Radic Libre Biol Med. 1995; 18:321-336.
- Leonard SS, Harris GK, Shi X. Estrés oxidativo inducido por metales y transducción de señales. Radic Libre Biol Med. 2004;37:1921-1942.
- Shi H, Shi X, Liu KJ. Mecanismo oxidativo de toxicidad por arsénico y carcinogénesis. Mol Cell Biochem. 2004;255:67–78.
- Pi J, Horiguchi S, Sun Y, Nikaido M, Shimojo N, Hayashi T. Un mecanismo potencial para el deterioro de la formación de óxido nítrico causado por la exposición oral prolongada al arseniato en conejos. Free Radic Biol Med.2003;35:102–113.
- Rin K, Kawaguchi K, Yamanaka K, Tezuka M, Oku N, Okada S. Las roturas de la cadena de ADN inducidas por el ácido dimetilarsínico, un metabolito del arsénico inorgánico, se ven fuertemente potenciadas por los radicales anión superóxido. Toro BiolPharm. 1995; 18:45–58.
- Waalkes MP, Liu J, Ward JM, Diwan LA. Mecanismos subyacentes a la carcinogénesis por arsénico: hipersensibilidad de ratones expuestos al arsénico inorgánico durante la gestación. Toxicología. 2004; 198: 31-38.
- Schiller CM, Fowler BA, Woods JS. Efectos del arsénico sobre la activación de la piruvato deshidrogenasa. Perspectiva de salud ambiental. 1977; 19:205-207.
- Monterio HP, Bechara EJH, Abdalla DSP. Participación de los radicales libres en porfirias neurológicas y envenenamiento por plomo. Mol Cell Biochem. 1991;103:73-83.
- Tripathi RM, Raghunath R, Mahapatra S. Plomo en sangre y su efecto sobre los niveles de Cd, Cu, Zn, Fe y hemoglobina de los niños. Sci Medio ambiente total. 2001;277:161-168.
- Nehru B, Dua R. El efecto del selenio en la dieta sobre la neurotoxicidad por plomo. J Medio Ambiente Pathol Toxicol Oncol. 1997; 16:47–50.
- Reid TM, Feig DI, Loeb LA. Mutagénesis por radicales de oxígeno inducidos por metales. Perspectiva de salud ambiental. 1994; 102 (suplemento 3): 57–61.
- Kinnula VL, Crapo JD. Superóxido dismutasas en el pulmón y enfermedades pulmonares humanas. Am J Respir Crit Care Med. 2003;167:1600–1619.
-
Kinnula VL. Producción y degradación de metabolitos de oxígeno durante estados inflamatorios en el pulmón humano. Curr Drug Targets Inflamm Allergy. 2005;4:465–470.
-
Zelko IN, Mariani TJ, Folz RJ. Familia multigénica de superóxido dismutasa: una comparación de las estructuras, la evolución y la expresión de los genes CuZn-SOD (SOD1), Mn-SOD (SOD2) y EC-SOD (SOD3). Radic Libre Biol Med. 2002;33:337–349.
- Kirkman HN, Rolfo M, Ferraris AM, Gaetani GF. Mecanismos de protección de la catalasa por NADPH. Cinética y estequiometría. J Biol Chem. 1999;274:13908–13914.
- Flohé L. Glutatión peroxidasa. Ciencias básicas de la vida. 1988;49:663–668.
- Arturo JR. Las glutatión peroxidasas. Célula Mol Life Sci. 2000;57:1825–1835.
- Chu FF, Doroshow JH, Esworthy RS. Expresión, caracterización y distribución tisular de una nueva glutatión peroxidasa celular dependiente de selenio, GSHPx-GI. J Biol Chem. 1993;268:2571–2576.
- Comhair SA, Bhathena PR, Farver C, Thunnissen FB, Erzurum SC. Inducción de glutatión peroxidasa extracelular en pulmones asmáticos: evidencia de regulación redox de la expresión en células epiteliales de las vías respiratorias humanas. FASEB J. 2001;15:70–78.
- Gromer S, Urig S, Becker K. El sistema de tiorredoxina de la ciencia a la clínica. Med Res Rev. 2004;24:40–89.
- Kinnula VL, Lehtonen S, Kaarteenaho-Wiik R, Lakari E, Pääkkö P, et al. Expresión celular específica de peroxirredoxinas en pulmón humano y sarcoidosis pulmonar. Tórax. 2002;57:157–164.
- Dubuisson M, Vander Stricht D, Clippe A, Etienne F, Nauser T, et al. La peroxirredoxina 5 humana es una peroxinitrito reductasa. FEBS Lett. 2004;571:161–165.
- Holmgren A. Función antioxidante de los sistemas de tiorredoxina y glutaredoxina. Señal antioxidante redox. 2000;2:811–820.
- Dickinson DA, Forman HJ. Glutatión en defensa y señalización: lecciones de un pequeño tiol. Ann NY Acad Sci. 2002;973:488–504.
- Sies H. El glutatión y su papel en las funciones celulares. Radic Libre Biol Med. 1999;27:916–921.
- Ladner JE, Parsons JF, Rife CL, Gilliland GL, Armstrong RN. Vías evolutivas paralelas para las glutatión transferasas: estructura y mecanismo de la enzima kappa de clase mitocondrial rGSTK1-1. Bioquímica. 2004; 43:52–61.
- Robinson A, Huttley GA, Stand HS, Junta PG. Los estudios de modelado y bioinformática de la glutatión transferasa de clase kappa humana predicen una nueva tercera familia de transferasas con homología con las 2-hidroxicromeno-2-carboxilato isomerasas procarióticas. Biochem J. 2004;379:541–552.
- Jakobsson PJ, Morgenstern R, Mancini J, Ford-Hutchinson A, Persson B. Características estructurales comunes de la superfamilia extendida MAPEGda de proteínas asociadas a la membrana con funciones muy divergentes en el metabolismo de eicosanoides y glutatión. Ciencia de las proteínas 1999;8:689–692.
- Hayes JD, Pulford DJ. La familia de supergenes de glutatión S-transferasa: regulación de GST y la contribución de las isoenzimas a la quimioprotección del cáncer y la resistencia a los medicamentos. Crit Rev Biochem Mol Biol. 1995; 30:445–600.
- Armstrong RN. Estructura, mecanismo catalítico y evolución de las glutatión transferasas. Chem Res Toxicol. 1997;10:2–18.
- Hayes JD, McLellan LI. El glutatión y las enzimas dependientes de glutatión representan una defensa regulada coordinadamente contra el estrés oxidativo. Res. de radicales libres 1999;31:273–300.
- Sheehan D, Meade G, Foley VM, Dowd CA. Estructura, función y evolución de las glutatión transferasas: implicaciones para la clasificación de miembros no mamíferos de una antigua superfamilia de enzimas. Biochem J. 2001;360:1-16.
- Cho SG, Lee YH, Park HS, Ryoo K, Kang KW, et al. La glutatión S-transferasa Mu modula las señales activadas por estrés al suprimir la quinasa 1 reguladora de señales de apoptosis. J Biol Chem. 2001;276:12749–12755.
- Dorion S, Lambert H, Landry J. La activación de la vía de señalización p38 por choque térmico implica la disociación de la glutatión S-transferasa Mu de Ask1. J Biol Chem. 2002;277:30792–30797.
- Adler V, Yin Z, Fuchs SY, Benezra M, Rosario L, et al. Regulación de la señalización de JNK por GSTp. EMBO J. 1999;18:1321-1334.
- Manevich Y, Feinstein SI, Fisher AB. La activación de la enzima antioxidante 1-CYS peroxirredoxina requiere glutatión mediada por heterodimerización con pGST. Proc Natl Acad Sci US A. 2004;101:3780–3785.
- Búnker VW. Radicales libres, antioxidantes y envejecimiento. Med Lab Sci. 1992;49:299-312.
- Mezzetti A, Lapenna D, Romano F, Costantini F, Pierdomenico SD, et al. El estrés oxidativo sistémico y su relación con la edad y la enfermedad. J Am Geriatr Soc. 1996;44:823–827.
- Blanco E, Shannon JS, Patterson RE. Relación entre vitamina y
uso de suplementos de calcio y cáncer de colon. Biomarcadores de Epidemiol de Cáncer Prev. 1997;6:769–774. - Masella R, Di Benedetto R, Vari R, Filesi C, Giovannini C. Nuevos mecanismos de compuestos antioxidantes naturales en sistemas biológicos: participación del glutatión y enzimas relacionadas con el glutatión. J Nutr Biochem. 2005;16:577–586.
- Curello S, Ceconi C, Bigoli C, Ferrari R, Albertini A, Guarnieri C. Cambios en el estado del glutatión cardíaco después de la isquemia y la reperfusión. Experiencia. 1985; 41:42-43.
- El-Agamey A, Lowe GM, McGarvey DJ, Mortensen A, Phillip DM, Truscott TG. Química de los radicales carotenoides y propiedades antioxidantes/prooxidantes. Arch Biochem Biophys. 2004;430:37–48.
- Rice-Evans CA, Sampson J, Bramley PM, Holloway DE. ¿Por qué esperamos que los carotenoides sean antioxidantes in vivo? Res. de radicales libres 1997; 26:381-398.
- NilesRM. Vías de señalización en la quimioprevención de retinoides y el tratamiento del cáncer. Mutat Res. 2004;555:81–96.
- Donato LJ, Noy N. Supresión del crecimiento del carcinoma mamario por ácido retinoico: los genes proapoptóticos son objetivos para el receptor de ácido retinoico y la señalización de la proteína II de unión al ácido retinoico celular. Cáncer Res. 2005;65:8193–8199.
- Niizuma H, Nakamura Y, Ozaki T, Nakanishi H, Ohira M, et al. Bcl-2 es un regulador clave para la muerte celular apoptótica inducida por ácido retinoico en el neuroblastoma. Oncogén. 2006;25:5046–5055.
- Dalton TP, Shertzer HG, Puga A. Regulación de la expresión génica por oxígeno reactivo. Ann Rev Pharmacol Toxicol. 1999;39:67–101.
- Scandalios JG. Respuestas genómicas al estrés oxidativo. En: Meyers RA, ed. Enciclopedia de Biología Celular Molecular y Medicina Molecular. Vol 5. 2ª ed. Weinheim, Alemania: Wiley-VCH; 2004: 489–512.
- Ghosh R, Mitchell DL. Efecto del daño oxidativo del ADN en elementos promotores sobre la unión del factor de transcripción. Ácidos Nucleicos Res. 1999;27:3213–3218.
- Marietta C, Gulam H, Brooks PJ. Una sola lesión de 8-ciclo-50-desoxiadenosina en una caja TATA evita la unión de la proteína de unión TATA y reduce fuertemente la transcripción in vivo. Reparación del ADN (Amst). 20;2002:1–967.
- Jackson AL, Chen R, Loeb LA. Inducción de inestabilidad de microsatélites
por daño oxidativo del ADN. Proc Natl Acad Sci US A. 1998;95:12468–12473. - Caldecott KW. Interacciones proteína-proteína durante la reparación de roturas monocatenarias de ADN de mamíferos. Biochem Soc Trans. 2003;31:247–251.
- Cooke MS, Evans MD, Dizdaroglu M, Lunec J. Daño oxidativo del ADN: mecanismos, mutación y enfermedad. FASEB J. 2003;17:1195-1214.
- Jones PL, Wolffe AP. Relaciones entre la organización de la cromatina y la metilación del ADN en la determinación de la expresión génica. Semin Cancer Biol. 1999;9:339–347.
- Girotti AW. Mecanismos de peroxidación lipídica. J Radic Libre Biol Med. 1985; 1:87–95.
- Siu GM, Draper HH. Metabolismo del malonaldehído in vivo e in vitro. lípidos. 1982; 17:349-355.
- Esterbauer H, Koller E, Slee RG, Koster JF. Posible implicación del producto de peroxidación lipídica 4-hidroxinonenal en la formación de cromolípidos fluorescentes. Biochem J. 1986;239:405-409.
- Hagihara M, Nishigaki I, Maseki M, Yagi K. Cambios dependientes de la edad en los niveles de peróxido de lípidos en las fracciones de lipoproteínas del suero humano. J Gerontol. 1984; 39:269-272.
- Keller JN, Mark RJ, Bruce AJ, Blanc E, Rothstein JD, et al. 4- El hidroxinonenal, un producto aldehídico de la peroxidación lipídica de la membrana, altera el transporte de glutamato y la función mitocondrial en los sinaptosomas. Neurociencia. 1997;806:85–96.
- Uchida K, Shiraishi M, Naito Y, Torii Y, Nakamura Y, Osawa T. Activación de las vías de señalización del estrés por el producto final de la peroxidación lipídica. El 4-hidroxi-2-nonenal es un inductor potencial de la producción de peróxido intracelular. J Biol Chem. 1999;274:2234–2242.
-
Suc I, Meilhac O, Lajoie-Mazenc I, Vandaele J, Jurgens G, Salvayre R, Negre-Salvayre A. Activation of EGF receptor by oxidated LDL. FASEB J. 1998;12:665–671.
-
Tsukagoshi H, Kawata T, Shimizu Y, Ishizuka T, Dobashi K, Mori M. 4-Hydroxy-2-nonenal mejora la producción de fibronectina por fibroblastos de pulmón humano IMR-90 en parte a través de la activación de la quinasa regulada por señal extracelular vinculada al receptor del factor de crecimiento epidérmico vía p44/42. Toxicol Appl Pharmacol. 2002;184:127–135.
- Montuschi P, Collins JV, Ciabattoni G, Lazzeri N, Corradi M, Kharitonov SA, Barnes PJ. 8-isoprostano exhalado como biomarcador in vivo de estrés oxidativo pulmonar en pacientes con EPOC y fumadores sanos. Am J Respir Crit Care Med. 2000;162:1175–1177.
- Morrison D, Rahman I, Lannan S, MacNee W. Permeabilidad epitelial, inflamación y estrés oxidativo en los espacios de aire de los fumadores. Am J Respir Crit Care Med. 1999;159:473–479.
- Nowak D, Kasielski M, Antczak A, Pietras T, Bialasiewicz P. Aumento del contenido de sustancias reactivas al ácido tiobarbitúrico y peróxido de hidrógeno en el condensado del aliento espirado de pacientes con enfermedad pulmonar obstructiva crónica estable: ningún efecto significativo del tabaquismo. Respiro Med. 1999;93:389–396.
- Kelly FJ, Mudway SI. Oxidación de proteínas en la interfase aire-pulmón. Aminoácidos. 2003; 25:375-396.
- Dean RT, Roberts CR, Jessup W. Fragmentación de polipéptidos extracelulares e intracelulares por radicales libres. Prog Clin Biol Res. 1985; 180:341-350.
- Keck RG. El uso de hidroperóxido de t-butilo como sonda para la oxidación de metionina en proteínas. Bioquímica anal. 1996;236:56–62.
- Davies KJ. Daño y degradación de proteínas por radicales de oxígeno. I. Aspectos generales. J Biol Chem. 1987;262:9895–9901.
- Stadtman ER. Oxidación catalizada por iones metálicos de las proteínas: mecanismo bioquímico y consecuencias biológicas. Gratis Radic Biol Med.
1990;9:315–325. - Fucci L, Oliver CN, Coon MJ, Stadtman ER. Inactivación de enzimas metabólicas clave por reacciones de oxidación de función mixta: posible implicación en el recambio de proteínas y el envejecimiento. Proc Natl Acad Sci US A. 1983;80:1521-1525.
- Stadtman ER, Moskovitz J, Levine RL. Oxidación de residuos de metionina de proteínas: consecuencias biológicas. Señal antioxidante redox. 2003;5:577–582.
- Stadtman ER, Levine RL. Oxidación mediada por radicales libres de aminoácidos libres y residuos de aminoácidos en proteínas. Aminoácidos. 2003;25:207–218.
- Urgencias Stadtman. Oxidación de proteínas en el envejecimiento y enfermedades relacionadas con la edad. Ann NY Acad Sci. 2001;928:22-38.
- Shacter E. Cuantificación y significado de la oxidación de proteínas en muestras biológicas. Drug Metab Rev. 2000;32:307-326.
- Poli G, Leonarduzzi G, Biasi F, Chiarpotto E. Estrés oxidativo y señalización celular. Curr Med Chem. 2004;11:1163–1182.
- Neufeld G, Cohen T, Gengrinovitch S, Poltorak Z. Factor de crecimiento endotelial vascular (VEGF) y sus receptores. FASEB J. 1999;13:9–22.
- Sundaresan M, Yu ZX, Ferrans VJ, Sulciner DJ, Gutkind JS, et al. Regulación de la generación de especies de oxígeno reactivo en fibroblastos por Rac1. Biochem J. 1996;318:379-382.
- Sol T, Oberley LW. Regulación redox de activadores transcripcionales. Radic Libre Biol Med. 1996; 21:335-348.
- Klatt P, Molina EP, De Lacoba MG, Padilla CA, Martinez-Galesteo E, Barcena JA, Lamas S. Redox regulator of c-Jun DNA binding by reversible S-glutathiolation. FASEB J. 1999;13:1481-1490.
- Reynaert NL, Ckless K, Guala AS, Wouters EF, van der Vliet A, Janssen Heininger
YM. Detección in situ de proteínas S-glutationiladas después de la derivatización de cisteína catalizada por glutaredoxina-1. Biochim Biophys Acta. 2006;1760:380–387. - Reynaert NL, Wouters EF, Janssen-Heininger YM. Modulación de la glutaredoxina-1
expresión en un modelo de ratón de enfermedad alérgica de las vías respiratorias. Am J Respir Cell Mol Biol. 2007;36:147–151. - Filomeni G, Rotilio G, Ciriolo MR. Señalización celular y el sistema redox del glutatión. Biochem Pharmacol. 2002;64:1057–1064.
- Pande V, Ramos MJ. Reconocimiento molecular de 15-deoxydelta (12,14) prostaglandina J(2) por factor nuclear-kappa B y otras proteínas celulares. Bioorg Med Chem Lett. 2005;15:4057–4063.
- Perkins ND. Integración de vías de señalización celular con función NF-kappaB e IKK. Nat Rev Mol Cell Biol. 2007;8:49–62.
- Gilmore TD. Introducción a NF-kappaB: jugadores, caminos, perspectivas. Oncogén. 2006;25:6680–6684.
- Hirota K, Murata M, Sachi Y, Nakamura H, Takeuchi J, Mori K, Yodoi J. Funciones distintas de la tiorredoxina en el citoplasma y en el núcleo. Un mecanismo de dos pasos de regulación redox del factor de transcripción NF-kappaB. J Biol Chem. 1999;274:27891–27897.
- Ward PA. Papel del complemento, las quimiocinas y las citocinas reguladoras en la lesión pulmonar aguda. Ann NY Acad Sci. 1996;796:104-112.
- Akira S, Kishimoto A. NF-IL6 y NF-kB en la regulación de genes de citoquinas. Adv Immunol. 1997;65:1-46.
- Meyer M, Schreck R, Baeuerle PA. El H2O2 y los antioxidantes tienen efectos opuestos sobre la activación de NF-kappa B y AP-1 en células intactas: AP-1 como factor de respuesta antioxidante secundario. EMBO J. 1993;12:2005-2015.
- Abate C, Patel L, Rausher FJ, Curran T. Regulación redox de la actividad de unión al ADN de fos y jun in vitro. Ciencia. 1990;249:1157-1161.
- Galter D, Mihm S, Droge W. Efectos distintos del disulfuro de glutatión en los factores de transcripción nuclear kB y la proteína activadora-1. Eur J Biochem. 1994;221:639–648.
- Hirota K, Matsui M, Iwata S, Nishiyama A, Mori K, Yodoi J. La actividad transcripcional de AP-1 está regulada por una asociación directa entre la tiorredoxina y Ref-1. Proc Natl Acad Sci US A. 1997;94: 3633–3638.
Publicar descargos de responsabilidad
Alcance de la práctica profesional *
La información aquí contenida en "El Paso, TX Estrés Oxidativo y Defensa Antioxidante" no pretende reemplazar una relación personal con un profesional de la salud calificado o un médico con licencia y no es un consejo médico. Lo alentamos a que tome decisiones de atención médica basadas en su investigación y asociación con un profesional de la salud calificado.
Información del blog y debates sobre el alcance
Nuestro alcance informativo se limita a la quiropráctica, musculoesquelética, medicina física, bienestar, contribuyendo etiológico alteraciones viscerosomáticas dentro de las presentaciones clínicas, la dinámica clínica del reflejo somatovisceral asociado, los complejos de subluxación, los problemas de salud delicados y/o los artículos, temas y debates de medicina funcional.
Brindamos y presentamos colaboración clínica con especialistas de diversas disciplinas. Cada especialista se rige por su ámbito de práctica profesional y su jurisdicción de licencia. Utilizamos protocolos funcionales de salud y bienestar para tratar y apoyar la atención de lesiones o trastornos del sistema musculoesquelético.
Nuestros videos, publicaciones, temas, asuntos e ideas cubren cuestiones clínicas, problemas y temas que se relacionan y respaldan directa o indirectamente nuestro ámbito de práctica clínica.*
Nuestra oficina ha intentado razonablemente proporcionar citas de apoyo y ha identificado el estudio o los estudios de investigación relevantes que respaldan nuestras publicaciones. Proporcionamos copias de los estudios de investigación de respaldo disponibles para las juntas reguladoras y el público a pedido.
Entendemos que cubrimos asuntos que requieren una explicación adicional de cómo puede ayudar en un plan de atención o protocolo de tratamiento en particular; por lo tanto, para discutir más a fondo el tema anterior, no dude en preguntar Dr. Alex Jiménez, DC, o póngase en contacto con nosotros en 915-850-0900.
Estamos aquí para ayudarlo a usted y a su familia.
Bendiciones
El Dr. Alex Jimenez corriente continua MSACP, enfermero*, CCCT, IFMCP*, CIFM*, ATN*
email: coach@elpasomedicinafuncional.com
Licenciado como Doctor en Quiropráctica (DC) en Texas & New Mexico*
Número de licencia de Texas DC TX5807, Nuevo México DC Número de licencia NM-DC2182
Licenciada como Enfermera Registrada (RN*) en Florida
Licencia de Florida N.° de licencia de RN RN9617241 (Control No. 3558029)
Estado compacto: Licencia multiestatal: Autorizado para ejercer en 40 Estados*
Matriculado actualmente: ICHS: MSN* FNP (Programa de enfermera practicante familiar)
Dr. Alex Jiménez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Mi tarjeta de presentación digital


 Antioxidantes Enzimáticos
Antioxidantes Enzimáticos


 De nuevo te doy la bienvenida.
De nuevo te doy la bienvenida.
Los comentarios están cerrados.